题目内容
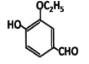
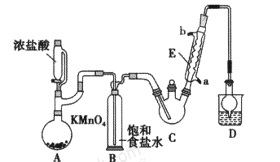
【题目】某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产三氯乙醛(CCl3CHO)的方法,由乙醇与氯气作用,制得三氯乙醛。
查阅资料,有关信息如下:
①制备反应原理:![]()
可能发生的副反应:![]()
![]()
②相关物质的相对分子质量及部分物理性质:
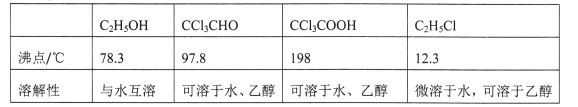
(1)仪器C和E的名称分别是____,____。
(2)仪器A中发生反应的离子方程式为____ 。
(3)该装置C最好采用____加热的方法,以控制反应温度在70℃左右。
(4)该设计流程中存在一处缺陷,该缺陷可能引起的后果是________。
(5)反应结束后,从C中的混合物中分离出CCl3COOH的方法是_____(填名称)。
【答案】 三颈瓶(或三口瓶) (球形)冷凝管 2MnO4- + 10Cl- + 16 H+ = 2Mn2+ + 5Cl2↑+ 8H2O 水浴 引入杂质C2H5Cl 和 CCl3COOH 蒸馏
【解析】
本题考查有机物制备。A装置利用高锰酸钾溶液与浓盐酸制备氯气,B装置用饱和食盐水除去氯气中的HCl,C装置氯气与乙醇反应中反应制备CCl3CHO,D装置盛放氢氧化钠溶液,吸收尾气中氯气和HCl,防止污染空气。
(1)根据仪器构造可知C是三颈烧瓶、E是球形冷凝管;(2)仪器A中高锰酸钾溶液与浓盐酸制备氯气,反应中高锰酸钾做氧化剂被还原为氯化锰,氯化氢做还原剂被氧化为氯气,反应的离子方程式为:MnO4- + 10Cl- + 16 H+ = 2Mn2+ + 5Cl2↑+ 8H2O;(3)装置C中控制反应温度在70℃左右,应采取水浴加热,达到受热均匀,偏于控制温度的目的;(4)由题给装置可知,生成的氯气中含有水蒸气,氯气能与水反应生成HCl与HClO,HCl和HClO能与乙醇发生副反应生成C2H5Cl和CCl3COOH,应在装置B和C之间增加一个干燥装置,除去氯气中的水蒸气;(5)CCl3COOH溶于乙醇与CCl3CHO,应采取蒸馏方法进行分离。

 期末集结号系列答案
期末集结号系列答案