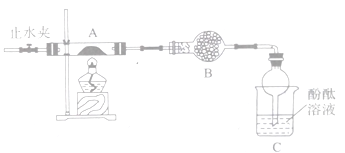
题目内容
【题目】A、B、C、D、E均是由下列离子组成的可溶性化合物.组成这五种物质的离子有(离子不能重复组合):
阳离子 | Na+、Mg2+、Al3+、Ba2+、Fe3+ |
阴离子 | OH﹣、Cl﹣、CO |
分别取它们进行实验,结果如下:
①A溶液与D溶液混合,没有明显现象;
②当B溶液加入到D溶液中时,有沉淀产生.继续加入B溶液,沉淀全部消失.
③将E溶液加热,有沉淀生成.
据此推断:A ;B ;C ;D ;E .
【答案】Fe2(SO4)3;Ba(OH)2;Na2CO3;AlCl3;Mg(HCO3)2
【解析】解:A、B、C、D、E均是由下列离子组成的可溶性化合物,根据当B溶液加入到D溶液中时,有沉淀产生,继续加入B溶液,沉淀全部消失,可推测是铝盐与强碱溶液反应的特征现象,B为强碱溶液;由于CO3 2﹣形成的可溶性盐只有Na2CO3 , 则强碱只有Ba(OH)2;由②知B为Ba(OH)2 , D只能为AlCl3;③将E溶液加热,有沉淀生成,可知E只能为Mg(HCO3)2;再由①知A为Fe2(SO4)3;则C为Na2CO3 , 所以A为:Fe2(SO4)3、B为:Ba(OH)2、C:为Na2CO3、D为:AlCl3、E为:Mg(HCO3)2 ,
所以答案是:Fe2(SO4)3;Ba(OH)2;Na2CO3;AlCl3;Mg(HCO3)2 .

【题目】在一定条件下有反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q)如表所示:
2SO3(g) △H=-197kJ/mol.现有容积相同的甲、乙、丙三个定容容器。在上述条件下分别充入的气体和反应放出的热量(Q)如表所示:
容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述不正确的是:
A. Q1<197
B. 在上述条件下,反应生成1molS03气体放热98.5kJ
C. Q2=Q3
D. Q3<Q1<2Q2