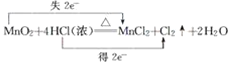
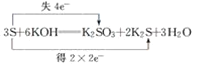
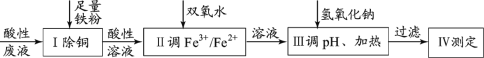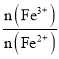题目内容
【题目】设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为2NA
B.7gCnH2n中含有的氢原子数目为NA
C.任何气体单质在标况下体积若为22.4L,则含有2NA个原子
D.1molNa2O2与水反应转移的电子数约为1.204×1024个
【答案】AB
【解析】
A.依据2H+~H2~2e-可知,铝跟氢氧化钠溶液反应生成1mol氢气,转移2mol电子,个数为2NA,选项A正确;
B.7 g CnH2n含有CH2物质的量为![]() =0.5mol,含有H数目为0.5mol×2×NA=NA,选项B正确;
=0.5mol,含有H数目为0.5mol×2×NA=NA,选项B正确;
C.稀有气体为单原子分子,1mol气体中含有NA个原子,选项C错误;
D.过氧化钠与水反应为歧化反应,过氧化钠即使氧化剂又是还原剂,1mol过氧化钠参加反应,转移1mol电子,个数为:6.02×1023个,选项D错误;
答案选AB。

练习册系列答案
相关题目
【题目】在100mL碳酸钠与碳酸氢钠的混合溶液中,加入氢氧化钡溶液,生成的沉淀如表:
实验序号 | 1 | 2 | 3 |
V(氢氧化钡溶液)/mL | 80 | 160 | 240 |
沉淀质量/g | 1.576 | 3.152 | 3.940 |
将实验3的悬浊液过滤,在滤液中加![]() 盐酸,恰好呈中性。
盐酸,恰好呈中性。
(1)氢氧化钡溶液的物质的量浓度为___。
(2)若将原100mL碳酸钠与碳酸氢钠的混合溶液加热蒸干并灼烧至恒重,得到![]() ___g。
___g。