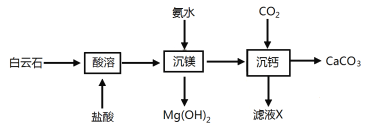
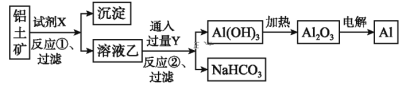
题目内容
【题目】在100mL碳酸钠与碳酸氢钠的混合溶液中,加入氢氧化钡溶液,生成的沉淀如表:
实验序号 | 1 | 2 | 3 |
V(氢氧化钡溶液)/mL | 80 | 160 | 240 |
沉淀质量/g | 1.576 | 3.152 | 3.940 |
将实验3的悬浊液过滤,在滤液中加![]() 盐酸,恰好呈中性。
盐酸,恰好呈中性。
(1)氢氧化钡溶液的物质的量浓度为___。
(2)若将原100mL碳酸钠与碳酸氢钠的混合溶液加热蒸干并灼烧至恒重,得到![]() ___g。
___g。
【答案】![]() 0.22
0.22
【解析】
从离子方程式的角度进行分析。向碳酸钠和碳酸氢钠的混合溶液中加入氢氧化钡溶液,发生的离子反应有: HCO3-+OH-=H2O+CO32-、Ba2++CO32-=BaCO3↓。从实验2和实验3沉淀质量的变化来看,实验2显然没有沉淀完全,假设实验3中的240mL溶液仍能完全将Ba2+沉淀,应生成的沉淀的质量是![]() =4.728g>3.940g,所以实验3中溶液中的所有的碳酸钠和碳酸氢钠均已反应完全。
=4.728g>3.940g,所以实验3中溶液中的所有的碳酸钠和碳酸氢钠均已反应完全。
(1)据以上分析,实验2中加入的钡离子完全沉淀,发生反应Ba2++CO32-=BaCO3↓,n[Ba(OH)2]=n(Ba2+)=n(BaCO3)=![]() =0.016mol,所以c[Ba(OH)2]=
=0.016mol,所以c[Ba(OH)2]=![]() =0.1mol/L;
=0.1mol/L;
(2)240mL氢氧化钡溶液中氢氧化钡的物质的量为:0.24L×0.1mol/L=0.024mol,其中OH-的物质的量为0.048mol。实验3的滤液中加入100mL 0.38mol/L盐酸恰好完全中和剩余的OH-,其物质的量为0.038mol,所以100mL原混合溶液中HCO3-消耗的OH-的物质的量为:0.048mol-0.038mol=0.01mol,则据反应式HCO3-+OH-=H2O+CO32-可知原溶液中NaHCO3的物质的量为0.01mol。实验3中共生成BaCO3沉淀0.02mol,其中NaHCO3生成的BaCO3沉淀是0.01mol,所以碳酸钠生成的BaCO3沉淀是0.01mol,所以原溶液中含有Na2CO3 0.01mol。将原混合溶液加热蒸干并灼烧至恒重,只有碳酸氢钠受热分解:![]() ,0.01mol NaHCO3完全分解生成二氧化碳0.005mol,其质量为0.005mol×44g/mol=0.22g。
,0.01mol NaHCO3完全分解生成二氧化碳0.005mol,其质量为0.005mol×44g/mol=0.22g。

 科学实验活动册系列答案
科学实验活动册系列答案