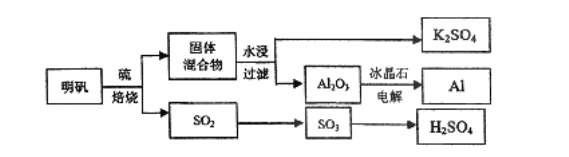
题目内容
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( ) 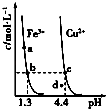
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
C.加适量NH4Cl固体可使溶液由a点变到b点
D.c、d两点代表的溶液中c(H+)与c(OH﹣)乘积相等
【答案】C
【解析】解:A.由b、c两点对应数据可比较出KSP[Fe(OH)3]与KSP[Cu(OH)2]的大小,KSP[Fe(OH)3]=c(Fe3+)(OH﹣)3=c(Fe3+)(10﹣12.7)3,
KSP[Cu(OH)2]=c(Cu2+)(OH﹣)2=c(Cu2+)(10﹣9.6)2,因c(Fe3+)=c(Cu2+),故KSP[Fe(OH)3]<KSP[Cu(OH)2],故A正确
B.b、c两点分别处在两条的沉淀溶解平衡曲线上,故两点均代表溶液达到饱和,故B正确;
C.向溶液中加入NH4Cl固体,不会导致溶液中的c(OH﹣)增大,故不能使溶液由a点变到b点,故C错误;
D.只要温度不发生改变,溶液中c(H+)与c(OH﹣)的乘积(即Kw)就不变.该题中温度条件不变,故c、d两点代表的溶液中c(H+)与c(OH﹣)的乘积相等,故D正确.
故选C.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】下表列出8种元素在元素周期表中的位置,结合所学内容回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)写出①的元素符号_________, 元素⑥的原子结构示意图____________________。
(2)写出元素⑤的最高价氧化物对应的水化物的电子式_____________, 该化合物中含有的化学键是_____________________。
(3)H元素分别与②、③、④形成的最稳定的气态氢化物是______________(写氢化物的化学式)。
(4)⑦、⑧是两种常见的非金属元素,从原子结构分析,原子半径⑦_______⑧(填写“>”或“<”);得电子能力较强是________ (填写元素符号);非金属性强弱关系是⑦_______⑧(填写“>”或“<”);⑧的单质通入⑦的钠盐溶液中,出现黄色沉淀,其离子方程式为_________________________________。
(5)某同学阅读课外资料,看到了下列有关锗、锡、铅三种元素的性质描述:
①锗、锡在空气中不反应,铅在空气中表面形成一层氧化铅;
②锗与盐酸不反应,锡与盐酸反应,铅与盐酸反应但生成PbCl2微溶而使反应终止;
③锗、锡、铅的+4价的氢氧化物的碱性强弱顺序是:Ge(OH)4<Sn(OH)4<Pb(OH)4。
该同学查找三种元素在周期表的位置如图所示:
Ⅳ | |
4 | Ge |
5 | Sn |
6 | Pb |
请解释产生上述性质变化的原因______________________________________。
【题目】结合所学内容回答下列问题:
Ⅰ.某实验小组以H2O2的分解为例,研究浓度、催化剂、温度对化学反应速率的影响,按照如下方案设计实验。
实验编号 | 反应物 | 催化剂 | 温度 |
① | 10 mL 2% H2O2溶液 | 无 | 20℃ |
② | 10 mL 5% H2O2溶液 | 无 | 20℃ |
③ | 10 mL 5% H2O2溶液 | 1-2滴1 mol/LFeCl3溶液 | 20℃ |
④ | 10 mL 5% H2O2溶液 | 无 | 20℃ |
⑤ | 10 mL 5% H2O2溶液 | ||
⑥ | 无 | 20℃ |
(1)实验①和②的目的是研究_______________对反应速率的影响。
(2)实验③和④测得生成氧气的体积随时间变化的关系如下图所示。
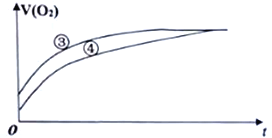
分析上图能够得出的实验结论是________________________________________________。
(3)实验⑤和⑥是研究温度相差10℃对反应速率的影响,请在上面表格空白处补齐对应的内容_________。
Ⅱ.某温度时,在2L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
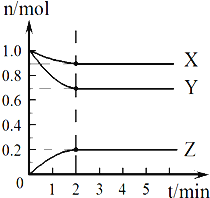
(4)反应开始至2 min,Z的平均反应速率____________。
(5)保持容器容积不变,在第2min时改变下列条件时,化学反应速率的变化是:
①向其中充入1 molX气体,化学反应速率_______(填 “加快”“减慢”或“不变”,下同);
②向其中充入1 mol N2(g) (N2不参加反应),化学反应速率_______________;
③同时加入0.9molX、0.7molY 和0.2molZ,化学反应速率________________。