题目内容
【题目】结合所学内容回答下列问题:
Ⅰ.某实验小组以H2O2的分解为例,研究浓度、催化剂、温度对化学反应速率的影响,按照如下方案设计实验。
实验编号 | 反应物 | 催化剂 | 温度 |
① | 10 mL 2% H2O2溶液 | 无 | 20℃ |
② | 10 mL 5% H2O2溶液 | 无 | 20℃ |
③ | 10 mL 5% H2O2溶液 | 1-2滴1 mol/LFeCl3溶液 | 20℃ |
④ | 10 mL 5% H2O2溶液 | 无 | 20℃ |
⑤ | 10 mL 5% H2O2溶液 | ||
⑥ | 无 | 20℃ |
(1)实验①和②的目的是研究_______________对反应速率的影响。
(2)实验③和④测得生成氧气的体积随时间变化的关系如下图所示。

分析上图能够得出的实验结论是________________________________________________。
(3)实验⑤和⑥是研究温度相差10℃对反应速率的影响,请在上面表格空白处补齐对应的内容_________。
Ⅱ.某温度时,在2L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:

(4)反应开始至2 min,Z的平均反应速率____________。
(5)保持容器容积不变,在第2min时改变下列条件时,化学反应速率的变化是:
①向其中充入1 molX气体,化学反应速率_______(填 “加快”“减慢”或“不变”,下同);
②向其中充入1 mol N2(g) (N2不参加反应),化学反应速率_______________;
③同时加入0.9molX、0.7molY 和0.2molZ,化学反应速率________________。
【答案】 浓度 FeCl3溶液是过氧化氢分解的催化剂,加快反应速率
⑤ | 无 | 10℃或30℃ | |
⑥ | 10 mL 5% H2O2溶液 |
0.05mol/(L·min) 加快 不变 加快
【解析】分析:(1)根据实验①和②的浓度不同分析;
(2)由图可知,③的反应速率大,④的反应速率最小,以此来解答;
(3)要探究温度对反应速率的影响,除了温度以外,其它变量均是相同的;
(4)根据反应速率是浓度的变化量与时间的比值计算;
(5)根据浓度、压强等外界条件对反应速率的影响分析解答。
详解:(1)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;
(2)由图可知,③的反应速率大,④的反应速率小,结合实验方案可知,③中加入了氯化铁溶液,说明氯化铁起催化剂的作用,因此能够得出的实验结论是FeCl3溶液是过氧化氢分解的催化剂,加快反应速率;
(3)由于实验⑤和⑥是研究温度相差10℃对反应速率的影响,因此其余变量均是相同的,则对应的内容为
⑤ | 无 | 10℃或30℃ | |
⑥ | 10 mL 5% H2O2溶液 |
。
(4)反应开始至2 min,生成Z是0.2mol,浓度是0.1mol/L,则Z的平均反应速率为0.1mol/L÷2min=0.05 mol/(L·min)。
(5)①向其中充入1 molX气体,X的浓度增大,则化学反应速率加快;
②向其中充入1 mol N2(g),由于N2不参加反应,反应物和生成物的浓度不变,则化学反应速率不变;
③同时加入0.9molX、0.7molY 和0.2molZ,物质的浓度均增大,因此化学反应速率加快。

【题目】铬是广泛存在于环境中的金属元素,在水体中主要以三价和六价铬的化合物为主,其中六价铬对人有害。通常含六价铬的酸性工业废水的处理流程为:
![]()
请回答下列问题:
I.(1)第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
a.Cr2O72-和CrO42-的浓度相同 b.2v (Cr2O72-) = v (CrO42-) c.溶液的颜色保持不变
(2)常温下,向100mL、0.1mol/L的K2CrO4溶液加入1mol/L硫酸10mL,存在平衡:
2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O K=5×1014
Cr2O72-(橙色)+H2O K=5×1014
若向上述溶液中加入浓KOH溶液,溶液的颜色由橙色渐变为黄色,反应逆转:Cr2O72-(橙色) +2OH-![]() 2CrO42-(黄色) +H2O
2CrO42-(黄色) +H2O
设该反应的平衡常数为K1,则K1=_______________。
II.为进一步研究初始pH和草酸浓度对第②步反应速率的影响,某学习小组设计对比实验如下表:
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
甲 | 4 | 60 | 10 | 30 |
乙 | 5 | x | 10 | 30 |
丙 | 5 | y | 5 | z |
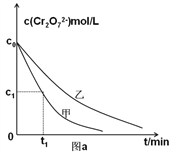
(3)实验设计表中z=_______mL;
(4)实验甲中0~t1时间段反应速率v(Cr3+)=________mol/(L·min) (用含字母的代数式表示)。
(5)常温下,第③步生成的Cr(OH)3在溶液中存在以下平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。