��Ŀ����
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�á�
��1����ͼ��ʾһ������,װ�е��Һa��X��Y������缫��,ͨ��������ֱ����Դ����.��ش���������:

����X��Y���Ƕ��Ե缫,a�DZ���NaCl��Һ,ʵ�鿪ʼʱ,ͬʱ�����߸����뼸�η�̪��Һ,��Y�缫�ϵĵ缫��ӦʽΪ____________��
�����õ�ⷽ��������ͭ,���Һaѡ��CuSO4��Һ,��X�缫�IJ�����_________,Y�缫��ӦʽΪ__________________(˵��:���ʷ����ĵ缫��Ӧ����д��)��
��2��NOx��SO2�Ĵ����ŷ�����ɴ�����Ⱦ����Ҫԭ��,�о��䴦������,������Ϊ��Խ��Խ�ܵ����ǵ�����,��Ҫ��ش��������⡣
�ٸ��������е�SO2,��ʹ����O2��Ӧ���Ʊ�����,װ����ͼ��ʾ,X��Y��Ϊ��缫���ϡ�

������A��_______��X���ĵ缫��ӦʽΪ___________________________��
������5.6L(��״����)����Bʱ,ͨ�����ӽ���Ĥ��H+�ĸ���Ϊ__________��
��SO2Ҳ�������Ʊ�Na2S2O3������Ʒ���������ʡ�ij SO2�ƵõĴ˲�Ʒ��Ϊ���䴿�ȣ�ȷ��ȡWg�ò�Ʒ������������ˮ�ܽ�,���100ml��Һ��ȡ20mL���Ե�����ָʾ������0.2000 molL-1��ı���Һ�ζ�����Ӧԭ��Ϊ�� 2S2O32-+I2=S4O62-+2I-���ζ����յ�ʱ����Һ��ɫ�ı仯��_______________________________�����ĵ�ı���Һ���Ϊ20.00mL�����Ʒ�Ĵ���Ϊ����Na2S2O3��Է�������ΪM��____________________��
���𰸡�2Cl--2e- =Cl2 ��ͭ Cu - 2e- = Cu2+ SO2 SO2 - 2e- + 2H2O = SO42- + 4H+ NA ����6.02��1023�� �������һ�α�Һ,��Һ����ɫ��Ϊ��ɫɫ,��30�벻�ָ� ![]()
��������
��1���ٵ�ⱥ��ʳ��ˮʱ����������������ʧ��������������
�ڵ�ⷽ��������ͭ�����������Ǵ�ͭ�����������Ǿ�ͭ���������Һ�����Ǻ���ͭ���ӵ�����Һ��
��2���پ�X��Ϊ����ʧ���ӷ���������Ӧ��
�������ĵ缫��Ӧ����ʽO2+4H++4e-=2H2O�е������������ӵĸ�����
�ڵζ��յ���Һ����ɫ��Ϊ��ɫ������2S2O32-+I2=S4O62-+2I-���м��㡣
��1���ٺ͵�Դ�����������ĵ缫Y�����������õ缫��������ʧ���ӷ���������Ӧ����2Cl--2e-=Cl2����
�ڵ�ⷽ��������ͭ�����������Ǵ�ͭ�����������Ǿ�ͭ���������Һ�����Ǻ���ͭ���ӵ�����Һ������������ͭ��Һ����X�缫���������õ缫����Ӧ���Ǿ�ͭ��
Y�缫���������õ缫�����Ǵ�ͭ���缫��ӦΪ��Cu-2e-=Cu2+��
��2��������A��SO2��X��Ϊ����ʧ���ӷ���������Ӧ���ʵ缫��Ӧ����ʽΪSO2-2e-+2H2O=SO42-+4H+��
�������ĵ缫��Ӧ����ʽO2+4H++4e-=2H2O
22.4L 4NA
5.6L NA
��N��H+��=NA����6.02��1023����
�ڵζ����յ�ʱ����Һ��ɫ�ı仯Ϊ�������һ�α�Һ,��Һ����ɫ��Ϊ��ɫɫ,��30�벻�ָ���
����2S2O32-+I2=S4O62-+2I-��֪����Ʒ�Ĵ���Ϊ![]() ��
��

����Ŀ����������1mol��ѧ�������γ���̬ԭ������Ҫ��������![]() ��ʾ����ϱ�����Ϣ�ж�����˵������ȷ����( )
��ʾ����ϱ�����Ϣ�ж�����˵������ȷ����( )
���ۼ� | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. �������ȶ��Ĺ��ۼ���H-F��
C. H2(g)��2H(g) ��H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) ��H=-25kJ/mol
����Ŀ���Ҵ�����ȡ���ϡ��㾫��Ⱦ�ϡ�Ϳ�ϡ�ϴ�Ӽ��Ȳ�Ʒ��ԭ�ϣ�
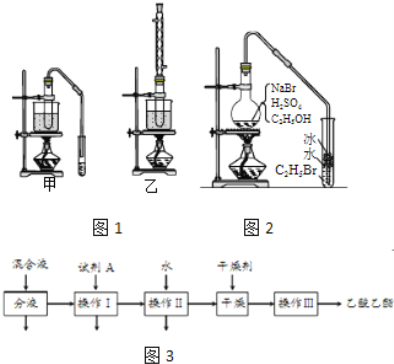
���������գ�
��1��ʵ�������Ҵ���ȡ��ϩʱ��Ũ���������ԶԶ������Ϊ����������������ԭ����______��
��2����֤��ϩ�ӳɷ�Ӧ����ʱ�������ϩ�����еĸ������ʽ��д�������ѡ�õ��Լ���______����д��ѧʽ������ȷ����ϩͨ����ˮ�з����˼ӳɷ�Ӧ����ʵ��______����ѡ���ţ�
a����ˮ��ɫ b������״��������
c����Ӧ��ˮ��Һ������ǿ d����Ӧ��ˮ��Һ�ӽ�����
��3��ʵ�������Ҵ��������Ʊ���������ʱ����������װ����ͼ1������ѡ�ã�����������װ�õ�˵����ȷ����______����ѡ���ţ�
���� | �е㣨�棩 |
�Ҵ� | 78.5 |
���� | 117.9 |
�������� | 77 |
a����װ������ת���ʸ� b����װ������ת���ʸ�
c����װ��������������ʩ d����װ��������������ʩ
��4������װ��ʵ��ʱ���ᴿ��������������������ͼ3�������������Լ�A�Ļ�ѧʽ��______����������������______��������һ�������ڷ���______����
��5����ͼ2�����Ҵ��Ʊ��������װ�ã�ʵ���������ּ��Ϸ�����
���ȼ��廯�����ټ��Ҵ�������1��1Ũ���
���ȼ��廯�����ټ�1��1Ũ�����������Ҵ���
�������ٺ͢�ʵ��ʱ�����ﶼ��������ɫ�������Թ��м���______������ɱ�Ϊ��ɫ���뷽������Ƚϣ������ڵ�����ȱ����______��





