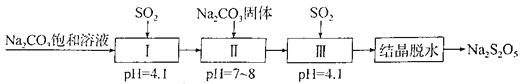
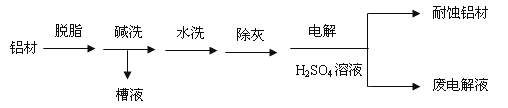
题目内容
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请回答下列问题:
(1)常温下,物质的量浓度均为0.1mol·L-1的六种溶液
①Na2CO3、②NaCl、③NaOH、④(NH4)2SO4、⑤CH3COONa、⑥NH4NO3 , pH从大到小排列顺序为__________(填序号)。
(2)已知T℃时,Kw=1×10-12,在该温度时,将pH=9的NaOH溶液bL与pH=2的H2SO4溶液aL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3, 则a :b=__________。
(3)现有HA、HB两种酸。室温下用0.1mol· L-1NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如下图。

①由图可知;酸性HA______HB,b点对应的溶液中c(HB)_____c(B-)(填“>”“<”或“=”)。
②室温下HB的电离平衡常数Ka的数量级为________。
【答案】③①⑤②⑥④ 2:9 > < 10-5
【解析】
(1)等浓度时强碱的pH最大,强碱弱酸盐中对应的酸性越强,水解程度越小,碳酸氢根离子的酸性小于醋酸,所以Na2CO3溶液的pH大于CH3COONa溶液;(NH4)2SO4溶液中铵根离子浓度大于NH4NO3溶液,(NH4)2SO4溶液的pH小于NH4NO3溶液,故pH从大到小排列顺序为③①⑤②⑥④;
(2)t℃时,Ksp=1×10-12,在t℃时pH=9的NaOH溶液中c(OH-)=![]() mol/L=0.001mol/L,pH=2的H2SO4溶液中c(H+)=0.01mol/L,若所得混合溶液的pH=3,即混合后溶液显酸性,则混合溶液中c(H+)=
mol/L=0.001mol/L,pH=2的H2SO4溶液中c(H+)=0.01mol/L,若所得混合溶液的pH=3,即混合后溶液显酸性,则混合溶液中c(H+)=![]() =0.001mol/L,解得a:b=2:9;
=0.001mol/L,解得a:b=2:9;
(3)①由图可知;0.1mol·L-1的HA、HB的pH分别为1和3,则HA完全电离为强酸,HB不完全电离为弱酸,则酸性HA>HB,b点对应的溶液为HB与NaB按1:1形成的溶液,溶液呈酸性,说明HB电离大于B-水解,则c(HB) <c(B-);
②由图可知;0.1mol·L-1的HB的pH为3,c(H+)=10-3mol/L,c(B-)![]() c(H+)=10-3mol/L,c(HB)
c(H+)=10-3mol/L,c(HB)![]() 0.1mol·L-1,室温下HB的电离平衡常数Ka=
0.1mol·L-1,室温下HB的电离平衡常数Ka=![]() ,数量级为10-5。
,数量级为10-5。