题目内容
【题目】下列说法正确的是
A.氧化还原反应的本质是电子的转移
B.化合反应一定是氧化还原反应
C.物质中某元素的原子得到电子,则此物质是还原剂
D.酸、碱、盐之间的反应一定是复分解反应
【答案】A
【解析】
A. 氧化还原反应的本质是电子的转移,特征是化合价的升降,故A正确;
B. 化合反应不一定是氧化还原反应,只有元素化合价发生变化时才是氧化还原反应,故B错误;
C. 元素失去电子,被氧化,该物质为还原剂,故C错误;
D. 离子反应中具有氧化性的离子和具有还原性的离子之间发生氧化还原反应,酸、碱、盐之间的反应可能会发生氧化还原反应,可能不是复分解反应,故D错误,
故选A。

【题目】某课外兴趣小组用下图装置探究条件对Na2S2O3溶液与稀H2SO4反应速率的影响。请回答有关问题。
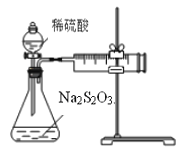
(1)写出该反应的离子方程式_______________________________________________________。
(2)连接好仪器后,开始实验前还需进行的操作是_____________________________________。
(3)现探究浓度对该反应速率(单位mL/min)的影响。
①应测定的实验数据为_____________。
②该实验实施过程中测定的气体体积比实际值偏小的一个重要原因是:____________________。
(4)若该小组同学设计了如下四组实验,
实验 | 反应温度 /℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | |||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | |||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 | |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 | |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 | |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 | |
① 实验数据体现了反应物__________(填化学式)的浓度及__________条件对反应速率的影响。
② 预测反应速率最快的一组实验序号为____________。
【题目】Ⅰ.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(moll) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图中表示NO2的变化的曲线是___________(填字母);
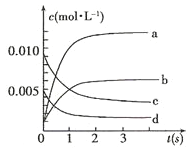
(2)800℃,反应达到平衡时,NO的转化率是___________;
(3)用O2表示从0~2s内该反应的平均速率v=___________。
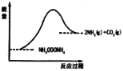
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
(1)下列不能判断该分解反应已经达到化学平衡状态的是___________(填选项);
A.2v生(NH3)=v耗(CO2) B.密闭容器中氨气的物质的量不变
C.容器中CO2与NH3的物质的量之比保持不变 D.密闭容器中总压强保持不变
E.形成6个N-H键的同时有2个C=O键断裂
(2)能使该反应的反应速率增大的是___________(填选项);
A.及时分离出CO2气体 B.适当升高温度
C.加入少量NH2COONH4(s) D.选择高效催化剂
(3)如图所示,上述反应中断开反应物中化学键吸收的能量___________形成生成物中化学键放出的能量(填写“大于”“等于”“小于”)。