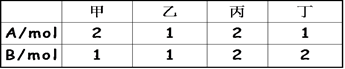题目内容
在恒温恒容的密闭容器中通入1 molN2和X molH2发生如下反应:N2+3H2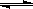 2NH3。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%。
2NH3。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%。
(1)起始时充入H2物质的量为_____________mol;
(2)该反应的热化学方程式为_________________________________________;
(3)若起始时加入N2、H2、NH3的物质的量分别为a、b、c,达到平衡时各组分物质的量与上述平衡相同。
①若维持反应向正方向进行,则起始时c的取值范围是_______________________。
②若c="2" mol,在相同条件下达到平衡时,该反应吸收的热量为______________kJ。
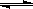 2NH3。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%。
2NH3。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%。(1)起始时充入H2物质的量为_____________mol;
(2)该反应的热化学方程式为_________________________________________;
(3)若起始时加入N2、H2、NH3的物质的量分别为a、b、c,达到平衡时各组分物质的量与上述平衡相同。
①若维持反应向正方向进行,则起始时c的取值范围是_______________________。
②若c="2" mol,在相同条件下达到平衡时,该反应吸收的热量为______________kJ。
(1)3
(2)N2(g)+3H2(g) 2NH3(g);△H=-92.0 kJ/mol
2NH3(g);△H=-92.0 kJ/mol
(3)① 0 mol≤c<0.4 mol ②73.6
(2)N2(g)+3H2(g)
 2NH3(g);△H=-92.0 kJ/mol
2NH3(g);△H=-92.0 kJ/mol (3)① 0 mol≤c<0.4 mol ②73.6
(1)容器内的压强变为原来的90%,所以原来容器中气体的总的物质的量是3.6mol÷0.9=4.0mol,因此X=4.0mol-1mol=3.0mol。
(2)设消耗氮气是amol,则消耗氢气是3amol,所以生成氨气是2amol,则1-a+3-3a+2a=3.6,解得a=0.2mol,因此该反应的热化学方程式是N2(g)+3H2(g) 2NH3(g);△H=-92.0 kJ/mol 。
2NH3(g);△H=-92.0 kJ/mol 。
(3)①由于平衡时氨气的物质的量是0.4mol,所以若维持反应向正方向进行,则起始时c的取值范围是 0 mol≤c<0.4 mol。
②若c="2" mol,则平衡时消耗氨气是1.6mol,所以吸收的热量0.8mol×92.0 kJ/mol=73.6kJ。
(2)设消耗氮气是amol,则消耗氢气是3amol,所以生成氨气是2amol,则1-a+3-3a+2a=3.6,解得a=0.2mol,因此该反应的热化学方程式是N2(g)+3H2(g)
 2NH3(g);△H=-92.0 kJ/mol 。
2NH3(g);△H=-92.0 kJ/mol 。(3)①由于平衡时氨气的物质的量是0.4mol,所以若维持反应向正方向进行,则起始时c的取值范围是 0 mol≤c<0.4 mol。
②若c="2" mol,则平衡时消耗氨气是1.6mol,所以吸收的热量0.8mol×92.0 kJ/mol=73.6kJ。

练习册系列答案
相关题目
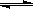 bB(g)达到平衡后,保持温度不变,将容器体积缩小一半,当达到新平衡时,B的浓度是原来的1.6倍,则( )
bB(g)达到平衡后,保持温度不变,将容器体积缩小一半,当达到新平衡时,B的浓度是原来的1.6倍,则( ) 2NO2(g) ΔH=+52.70 kJ·mol—1。在恒温、恒容的密闭容器中进行上述反应,达到平衡时,描述中不正确的是
2NO2(g) ΔH=+52.70 kJ·mol—1。在恒温、恒容的密闭容器中进行上述反应,达到平衡时,描述中不正确的是 5C(g),起始时4个容器所盛A2和B2的量如下表所示:
5C(g),起始时4个容器所盛A2和B2的量如下表所示: 2C(g)达到平衡的标志的是( )
2C(g)达到平衡的标志的是( ) KI3,有关KI3的叙述中不正确的是
KI3,有关KI3的叙述中不正确的是 nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)在一定条件下达到平衡后,改变下列条件,请回答: CH3OH(g),甲醇生成量与时间的关系如图所示。下列有关说法正确的是.
CH3OH(g),甲醇生成量与时间的关系如图所示。下列有关说法正确的是.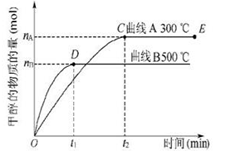
 3C(g)+2D(g) ,起始时四个容器内所装A、B的量如下:
3C(g)+2D(g) ,起始时四个容器内所装A、B的量如下: