题目内容
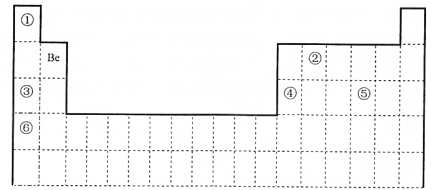
【题目】下表为元素周期表的一部分, 回答下列问题。
(1)我国科学家采用“铝铍测年法”测量“北京人”年龄。10Be 和9Be______________
a.是同一种核素 b.具有相同的中子数 c.互为同素异形体 d.互为同位素
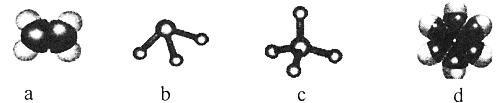
(2)元素①和②可形成多种化合物。下列模型表示的分子中,不可能由①和②形成的是_______(填序号)。
(3)元素①~⑥中,金属性最强的是___(填元素符号)。②的单质和⑤的最高价氧化物对应水化物的浓溶液反应的化学方程式为______________。
(4)碘(53I) 是人体必需的微量元素之一。
①碘(53I) 在周期表中的位置是______
②CI-、Br-、I-的还原性由大到小的顺序为_______。
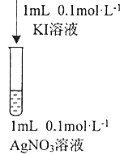
③资料显示: Ag+和I-会发生氧化还原反应生成两种单质,反应的离子方程式为_______。某同学用图实验验证上述反应,观察到两溶液混合后立即出现黄色浑浊,再加入淀粉溶液,不变蓝。分析产生上述现象的可能原因:________________
【答案】d b K
C+2H2SO4(浓)![]() CO2↑+ 2SO2↑+2H2O 第五周期ⅦA (或第5周期ⅦA) I->Br->Cl- 2Ag++2I-=2Ag↓+I2 Ag+和I-发生氧化还原反应的速率慢于发生沉淀反应的速率。物质的氧化性、还原性受浓度或温度影响,溶液中离子浓度较小或温度不够,氧化还原反应不易发生
CO2↑+ 2SO2↑+2H2O 第五周期ⅦA (或第5周期ⅦA) I->Br->Cl- 2Ag++2I-=2Ag↓+I2 Ag+和I-发生氧化还原反应的速率慢于发生沉淀反应的速率。物质的氧化性、还原性受浓度或温度影响,溶液中离子浓度较小或温度不够,氧化还原反应不易发生
【解析】
质子数相同,中子数不同的一类原子互称为同位素;根据元素在周期表中的位置可知,①为H元素,②为C元素,③为Na元素,④为Al元素,⑤为S元素,⑥为K元素。
(1) 10Be和9Be的质子数相同,但中子数不同,故两者互为同位素。
(2)元素①为H和②为C,两者形成分子时,C原子能形成4条共价键,H原子形成1条共价键。a为乙烯,c为甲烷,d为苯,均由C、H组成; 但c分子的中心原子形成3条键,不符合碳的四价键原子,故不是由C、H元素形成的。
(3)同周期从左到右,同主族从上到下,元素金属性越来越强,故元素①~⑥中,金属性最强的是K。②的单质为C,⑤的最高价氧化物对应水化物的浓溶液为浓硫酸,碳与浓硫酸反应生成二氧化硫、二氧化碳和水,反应的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(4)①碘(53I)在周期表中的位置是第五周期ⅦA (或第5周期ⅦA)。
②同主族从上到下,相应阴离子的还原性越来越强,故CI-、Br-、I-的还原性由大到小的顺序为I->Br->Cl-。
③Ag+和I-会发生氧化还原反应生成两种单质,这两种单质为银和碘,故反应的离子方程式为2Ag++2I-=2Ag↓+I2;碘化钾溶液和硝酸银溶液混合后立即出现黄色浑浊,再加入淀粉溶液,不变蓝,则银离子与碘离子反应生成碘化银,原因可能为Ag+和I-发生氧化还原反应的速率慢于发生沉淀反应的速率;物质的氧化性、还原性受浓度或温度影响,溶液中离子浓度较小或温度不够,氧化还原反应不易发生。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案