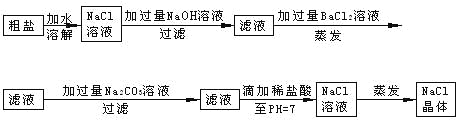
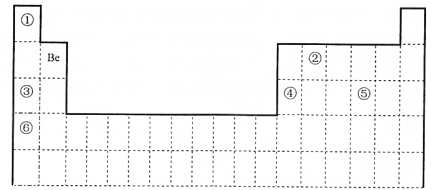
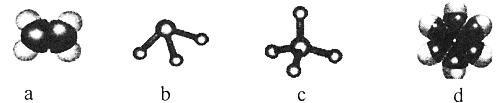
题目内容
【题目】铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用.回答下列问题:
(1)![]() 的名称是三硝酸六尿素合铁
的名称是三硝酸六尿素合铁![]() Ⅲ
Ⅲ![]() ,是一种重要的配合物.该化合物中
,是一种重要的配合物.该化合物中![]() 的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___
的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___![]() 碳原子为____杂化,
碳原子为____杂化,![]() 的空间构型为_____.
的空间构型为_____.
(2)尿素分子中![]() 键
键![]() 键的数目之比_____.
键的数目之比_____.
(3)目前发现的铝原子簇![]() 的性质与卤素相似,则原子簇
的性质与卤素相似,则原子簇![]() 属于____晶体.
属于____晶体.![]() 存在的化学键有_____
存在的化学键有_____![]() 填字母
填字母![]() .
.
A.离子键 ![]() 极性键
极性键 ![]() 非极性键
非极性键 ![]() 配位键
配位键 ![]() 氢键
氢键 ![]() 金属键
金属键
(4)已知: ,反应后,
,反应后,![]() 键_____,
键_____,![]() 键_____
键_____![]() 填“增加”或“减少”
填“增加”或“减少”![]() .
.
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”,如
键”,如![]() 分子中存在“离域
分子中存在“离域![]() 键”,可表示成
键”,可表示成![]() ,则
,则![]()
![]() 咪唑
咪唑![]() 中的“离域
中的“离域![]() 键”可表示为_________
键”可表示为_________
(6)奥氏体是碳溶解在![]() 中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为
中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为![]() ,则晶胞中最近的两个碳原子之间的距离为______
,则晶胞中最近的两个碳原子之间的距离为______![]() 阿伏加德罗常数的值用
阿伏加德罗常数的值用![]() 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可![]() .
.

【答案】![]() 或
或![]()
![]()
![]() 杂化 平面三角形
杂化 平面三角形 ![]() 分子 ABD 减少 减少
分子 ABD 减少 减少 ![]()
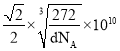
【解析】
(1)Fe是26号元素,原子核外电子排布式为s22s23p63s23p63d64s2,失去4s能级2个电子,再失去3d能级1个电子形成Fe3+;同周期主族元素自左而右电负性增大,C、N、O在它们的氢化物中均表现负价,说明它们对键合电子比H元素的强;C原子形成2个C-N键、1个C=O双键,没有孤对电子,杂化轨道数目为3;NO3-中N原子孤电子对数=![]() =0、价层电子对数=0+3=3;
=0、价层电子对数=0+3=3;
(2)CO(NH2)2分子中含有1个![]() 键、2个
键、2个![]() 键、4个
键、4个![]() 键,单键为
键,单键为![]() 键,双键含有1个
键,双键含有1个![]() 键、1个
键、1个![]() 键,分子中有7个
键,分子中有7个![]() 键、1个
键、1个![]() 键;
键;
(3)铝原子簇A113的性质与卤素相似,说明原子簇A113属于分子晶体。Na+、[Al(OH)4]- 之间形成离子键,[Al(OH)4]-中Al3+与OH-之间存在配位键,O原子与H原子之间形成极性键;
(4)反应发生加成反应,生成物与反应物相比σ键增加了1个,而π键减少1个;
(5)环上原子处于同一平面,碳原子及形成碳碳双键的N原子采取sp2杂化,均有1个单电子处于平行的p轨道内,形成单键的N原子有1对孤对电子,“离域π键”为5原子、6电子形成大派键;
(5)Fe原子处于顶点、面心,碳原子处于体心、棱中心,均摊法计算Fe、C原子数目,计算晶胞中原子总质量,晶胞中最近的两个碳原子的距离为同一顶点的2条棱中心2个碳原子的距离,结合晶胞中原子总质量=晶胞体积×晶体密度计算。
![]() 原子核外有26个电子,核外电子排布为
原子核外有26个电子,核外电子排布为![]() ,Fe原子失去4s能级2个电子、3d能级1个电子形成
,Fe原子失去4s能级2个电子、3d能级1个电子形成![]() ,Fe
,Fe![]() 电子排布式为
电子排布式为![]() 或
或![]() ;
;![]() 中所含非金属元素为H、C、N、O,通常元素的非金属性越强,电负性越大,则所含非金属元素C、N、O、H中O的非金属性最强,H最弱,四者的电负性由大到小的顺序是O、N、C、H;碳原子形成以碳氧双键和两个碳氮单键,无孤电子对,则其杂化类型为
中所含非金属元素为H、C、N、O,通常元素的非金属性越强,电负性越大,则所含非金属元素C、N、O、H中O的非金属性最强,H最弱,四者的电负性由大到小的顺序是O、N、C、H;碳原子形成以碳氧双键和两个碳氮单键,无孤电子对,则其杂化类型为![]() 杂化;
杂化;![]() 中价层电子对个数为3且不含孤电子对,所以为平面三角形;
中价层电子对个数为3且不含孤电子对,所以为平面三角形;
![]() 分子中含有1个
分子中含有1个![]() 键、2个
键、2个![]() 键、4个
键、4个![]() 键,单键为
键,单键为![]() 键,双键含有1个
键,双键含有1个![]() 键、1个
键、1个![]() 键,分子中有7个
键,分子中有7个![]() 键、1个
键、1个![]() 键,
键,![]() 分子中含有的
分子中含有的![]() 键与
键与![]() 键的数目之比为7:1;
键的数目之比为7:1;
![]() 卤素单质属于分子晶体,铝原子簇
卤素单质属于分子晶体,铝原子簇![]() 的性质与卤素相似,则原子簇
的性质与卤素相似,则原子簇![]() 也属于分子晶体。
也属于分子晶体。![]() 属于离化合物,存在着离子键,铝是缺电子结构,能接受氢氧根离子给与的孤对电子形成配位键,氧氢之间可以形成极性键。所以
属于离化合物,存在着离子键,铝是缺电子结构,能接受氢氧根离子给与的孤对电子形成配位键,氧氢之间可以形成极性键。所以![]() 属于离化合物中含有离子键、极性键、配位键;
属于离化合物中含有离子键、极性键、配位键;
![]() 每生成1mol氯吡苯脲,需要
每生成1mol氯吡苯脲,需要![]() 氯
氯![]() 氨基吡啶、1mol异氰酸苯酯,反应过程中每个
氨基吡啶、1mol异氰酸苯酯,反应过程中每个![]() 氯
氯![]() 氨基吡啶分子断裂一个
氨基吡啶分子断裂一个![]() 键、每个异氰酸苯酯分子断裂一个
键、每个异氰酸苯酯分子断裂一个![]() 键,所以当
键,所以当![]() 键减少,
键减少,![]() 键也减少;
键也减少;
![]() 多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域
多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”。因为
键”。因为![]()
![]() 咪唑
咪唑![]() 中的有5个原子参与形成
中的有5个原子参与形成![]() 键,6个电子P轨道上的电子参与成键,所以咪唑的“离域兀键”可表示为
键,6个电子P轨道上的电子参与成键,所以咪唑的“离域兀键”可表示为![]() ;
;
![]() 晶胞结构分析可知一个晶胞中含铁原子
晶胞结构分析可知一个晶胞中含铁原子![]() ,碳原子
,碳原子![]() ,化学式中铁原子和碳原子比为1:1,化学式为FeC;晶胞中最近的两个碳原子的距离设为x,立方体棱边的一半为a,则
,化学式中铁原子和碳原子比为1:1,化学式为FeC;晶胞中最近的两个碳原子的距离设为x,立方体棱边的一半为a,则![]() ,
,![]() ,密度
,密度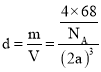 ,解得
,解得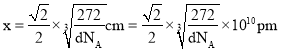 。
。

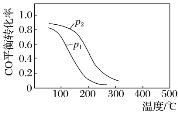
【题目】(1).用合成气生成甲醇的反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
CH3OH(g) ΔH,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200 ℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH________(填“>”“<”或“= ”)0。
②写出一条可同时提高反应速率和CO转化率的措施:________________________。
③下列说法正确的是________(填字母)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
④0~3 min内用CH3OH表示的反应速率v(CH3OH)=__________________。
⑤ 200 ℃时,该反应的平衡常数K=________。向上述200 ℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡________(填“正向”“逆向”或“不”)移动。