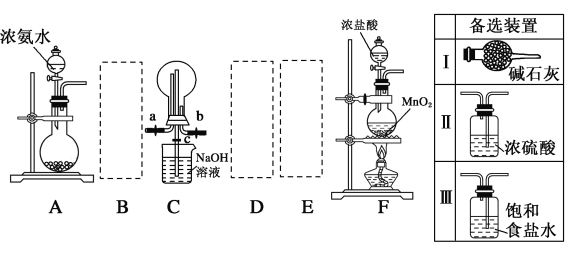
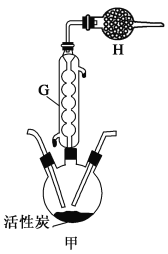
题目内容
【题目】锡酸钠(Na2SnO3·xH2O)主要用作电镀铜锡合金和碱性镀锡的基本原料。锡精矿除含SnO2外,还含有少量WO3、S、As、Fe,—种由锡精矿制备锡酸钠的工艺流程如下:
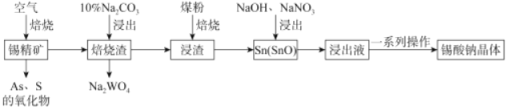
已知:①焙烧后,S、As变为挥发性氧化物而被除去,Fe变为Fe3O4;
②Na2SnO3xH2O。易溶于水,其在水中的溶解度随着温度的升高而降低。
请回答下列问题:
(1)Sn元素的原子序数为50,其在周期表中的位置为_____________。
(2)从“焙烧渣”中除去Fe3O4最简单的方法为_____________。加入煤粉焙烧可将SnO2还原为Sn或SnO,Sn或SnO。在碱性条件下均能被NaNO3氧化为Na2SnO3,已知NaNO3的还原产物为NH3,则NaNO3氧化Sn的化学方程式为___________________。
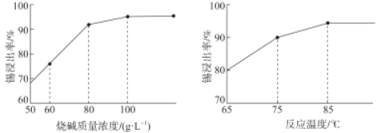
(3)如图为加入NaOH溶液和NaNO3溶液浸出时锡的浸出率与NaOH质量浓度和反应温度间的关系图,则“碱浸”的最适宜条件为_____________、___________,
(4)从浸出液中获得锡酸钠晶体的“一系列操作”具体是指___________、洗涤、干燥。
(5)采用热重分析法测定锡酸钠晶体样品所含结晶水数,将样品加热到140℃时,失掉全部结晶水,失重约20.2%。锡酸钠晶体的化学式为__________。
(6)以纯锡为阳极材料,以NaOH和Na2SnO3为电解液,待镀金属为阴极材料,可实现在待镀金属上的持续镀锡,镀锡时阳极的电极反应式为______________。
【答案】第五周期ⅣA族 用磁铁吸引 2Sn+3NaOH+NaNO3=2Na2SnO3+NH3↑ 烧碱质量浓度为100g/L 反应温度为85℃ 蒸发浓缩、趁热过滤 Na2SnO3·3H2O Sn-4e-+6OH-=SnO32-+3H2O
【解析】
(1)Sn元素的原子序数为50,由于在核外有5个电子层,最外层有4个电子;
(2)Fe3O4为磁性氧化铁,易被磁铁吸引;NaNO3氧化Sn生成Na2SnO3,同时生成氨气;
(3)由图可知,烧碱质量浓度为100g/L,反应温度为85℃时,“碱浸”时锡的浸出率最高;
(4)根据题给信息,锡酸钠晶体溶解度随温度变化规律进行分析操作方法;
(5)由![]() 计算Na2SnO3xH2O中的x;
计算Na2SnO3xH2O中的x;
(6)镀锡时碱性条件下阳极上锡失去电子产生SnO32-。
(1)Sn元素的原子序数为50,由于在核外有5个电子层,最外层有4个电子,故处于第五周期ⅣA族;
(2)Fe3O4为磁性氧化铁,易被磁铁吸引;从“焙烧渣”中除去Fe3O4最简单的方法为用磁铁吸引;
NaNO3氧化Sn生成Na2SnO3,同时生成氨气,反应的化学方程式为2Sn+3NaOH+NaNO3=2Na2SnO3+NH3↑;
(3)由图可知,烧碱质量浓度为100g/L,反应温度为85℃时,“碱浸”时锡的浸出率最高;
(4)从题给信息可知,锡酸钠晶体溶解度随温度升高溶解度减小,从浸出液中获得锡酸钠晶体的“一系列操作”具体是指蒸发浓缩、趁热过滤、洗涤、干燥;
(5)采用热重分析法测定锡酸钠晶体样品所含结晶水数,将样品加热到140℃时,失掉全部结晶水,失重约20.2%。锡酸钠晶体的化学式为Na2SnO3xH2O,则![]() ,解得x=3,故锡酸钠晶体的化学式为Na2SnO33H2O;
,解得x=3,故锡酸钠晶体的化学式为Na2SnO33H2O;
(6)以纯锡为阳极材料,以NaOH和Na2SnO3为电解液,待镀金属为阴极材料,可实现在待镀金属上的持续镀锡,镀锡时碱性条件下阳极上锡失去电子产生SnO32-,电极反应式为Sn-4e-+6OH-=SnO32-+3H2O。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案【题目】我国政府承诺,到2020年,单位GDP CO2排放量比2005年下降40%-45%。请回答下列问题:
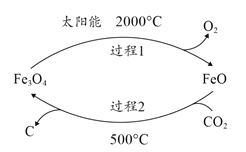
(1)利用太阳能工艺可将Fe3O4转化为FeO,然后利用FeO捕获CO2可得炭黑,其流程如上图所示。该循环中Fe3O4可视为_______(填“催化剂”、“中间产物”),过程2捕获1mo1CO2转移电子的物质的量是_______mol。
(2)以CO2和NH3为原料合成尿素[CO(NH2)2],反应如下:
2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-1595kJ·mol-1
H2NCOONH4 (s)=CO(NH2)2(s)+H2O(g) ΔH=+1165kJ·mol-1
H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
CO2(g)与NH3(g)合成尿素和液态水的热化学方程式_______________________;
(3)CH4-CO2催化重整可以得到燃料CO和H2。一定条件下在恒容的密闭容器中发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)能够说明上述反应已达到平衡状态的是______(填字母序号)。
2CO(g)+2H2(g)能够说明上述反应已达到平衡状态的是______(填字母序号)。
A.CO2和CH4的浓度相等
B.v正(CO2)=2v逆(CO)
C.每断裂4molC—H键的同时,断裂2molH—H键
D.容器中混合气体的平均相对分子质量保持不变
E.容器中混合气体的密度保持不变
(4)CO2是一种温室气体,但其本身无毒,处理废气时常将一些有毒物质转化为CO2。一定温度下,在三个容积均为2.0 L的密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
不同温度下,容器中各物质起始和平衡时的物质的量如下表所示:
容器 | 温度/℃ | 起始物质的量/mol | 平衡时物质的量/mol | |
NO(g) | CO(g) | CO2 | ||
甲 | 50 | 0.2 | 0.2 | 0.12 |
乙 | 100 | 0.2 | 0.2 | 0.1 |
丙 | 100 | 0.3 | 0.3 | |
下列说法正确的是___________
A.该反应的正反应为吸热反应
B.50℃时,若起始时向甲中充入0.1 mol N2和0.2 mol CO2,则达平衡时N2的转化率为40%
C.100℃时,若起始时向乙中充入的NO、CO、N2和CO2均为0.40 mol,则此时v正>v逆
D.达到平衡时,丙中CO2的体积分数比乙中的小