题目内容
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ·mol-1。则相同条件下破坏1 mol NO中的化学键需要吸收的能量为________kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=________mol·L-1;往溶液中加入少量NaOH固体,则溶液中![]() ___________(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:________。
___________(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:________。
(3)25℃时,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
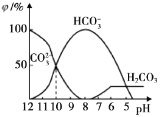
①在同一溶液中,H2CO3、HCO3-、CO32-____________(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的微粒主要为___________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=___________。
HCO3-+OH-的平衡常数Kh=___________。
【答案】631.5 10-9 不变 c(CH3COO-)+c(OH-)=c(Na+)+c(H+) 不能 HCO3- 10-4
【解析】
(1)反应焓变ΔH=反应物总键能-生成物总键能;(2)酸溶液中,氢离子抑制水的电离,溶液中的氢氧根全部来自于水的电离;(3)由图分析离子存在状态,判断离子共存问题。
(1) 1 mol NO中的化学键的键能=![]() ;
;
(2)25℃时,pH=5的CH3COOH溶液中,氢氧根全部由水电离产生,且c水(H+)=c水(OH-),即由水电离出的氢离子浓度c(H+)=c水(OH-)=![]() mol·L-1;往溶液中加入少量NaOH固体, 醋酸电离常数Ka=
mol·L-1;往溶液中加入少量NaOH固体, 醋酸电离常数Ka=![]() ,温度不变,电离常数不变;混合溶液中所有离子浓度之间的等式为电荷守恒关系,c(CH3COO-)+c(OH-)=c(Na+)+c(H+)。
,温度不变,电离常数不变;混合溶液中所有离子浓度之间的等式为电荷守恒关系,c(CH3COO-)+c(OH-)=c(Na+)+c(H+)。
(3) ①由图可知,碳酸根和碳酸无法共存,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存;
②由图可知,当pH=7时,溶液中含碳元素的微粒主要为HCO3-;
③根据图像可知反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=![]() =c(OH-)=10-4。
=c(OH-)=10-4。

【题目】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g)+3H2(g)![]() 2NH3(g)的化学平衡常数表达式为__。
2NH3(g)的化学平衡常数表达式为__。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是__。
序号 | 化学反应 | K(298K)的数值 |
① | N2(g)+O2(g) | 5×10-31 |
② | N2(g)+3H2(g) | 4.1×106 |
(3)某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.100mol/L,c(H2)=0.300mol/L的反应物进行合成氨反应,N2的浓度随时间的变化如图①、②、③曲线所示。
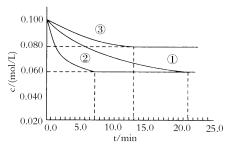
实验②平衡时H2的转化率为__。
据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:___理由:___。
③条件:___理由:___。