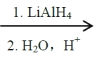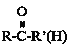题目内容
【题目】我国政府承诺,到2020年,单位GDP CO2排放量比2005年下降40%-45%。请回答下列问题:
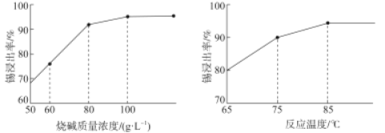
(1)利用太阳能工艺可将Fe3O4转化为FeO,然后利用FeO捕获CO2可得炭黑,其流程如上图所示。该循环中Fe3O4可视为_______(填“催化剂”、“中间产物”),过程2捕获1mo1CO2转移电子的物质的量是_______mol。
(2)以CO2和NH3为原料合成尿素[CO(NH2)2],反应如下:
2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-1595kJ·mol-1
H2NCOONH4 (s)=CO(NH2)2(s)+H2O(g) ΔH=+1165kJ·mol-1
H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
CO2(g)与NH3(g)合成尿素和液态水的热化学方程式_______________________;
(3)CH4-CO2催化重整可以得到燃料CO和H2。一定条件下在恒容的密闭容器中发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)能够说明上述反应已达到平衡状态的是______(填字母序号)。
2CO(g)+2H2(g)能够说明上述反应已达到平衡状态的是______(填字母序号)。
A.CO2和CH4的浓度相等
B.v正(CO2)=2v逆(CO)
C.每断裂4molC—H键的同时,断裂2molH—H键
D.容器中混合气体的平均相对分子质量保持不变
E.容器中混合气体的密度保持不变
(4)CO2是一种温室气体,但其本身无毒,处理废气时常将一些有毒物质转化为CO2。一定温度下,在三个容积均为2.0 L的密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
不同温度下,容器中各物质起始和平衡时的物质的量如下表所示:
容器 | 温度/℃ | 起始物质的量/mol | 平衡时物质的量/mol | |
NO(g) | CO(g) | CO2 | ||
甲 | 50 | 0.2 | 0.2 | 0.12 |
乙 | 100 | 0.2 | 0.2 | 0.1 |
丙 | 100 | 0.3 | 0.3 | |
下列说法正确的是___________
A.该反应的正反应为吸热反应
B.50℃时,若起始时向甲中充入0.1 mol N2和0.2 mol CO2,则达平衡时N2的转化率为40%
C.100℃时,若起始时向乙中充入的NO、CO、N2和CO2均为0.40 mol,则此时v正>v逆
D.达到平衡时,丙中CO2的体积分数比乙中的小
【答案】催化剂 4 2NH3(g)+CO2(g) = CO(NH2)2(s)+H2O(l) △H=-474 kJ·mol-1 CD BC
【解析】
(1) 利用太阳能工艺可将Fe3O4转化为FeO,然后利用FeO捕获CO2可得炭黑,结合流程图写出反应的总反应,据此分析解答;
(2)首先写出CO2(g)与NH3(g)合成尿素的化学方程式,再根据盖斯定律分析解答;
(3)反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,据此分析判断;
(4)A.根据温度对平衡的影响分析判断;B.50℃时,起始甲中充入0.1molN2和0.2molCO2所达到的平衡状态与50℃时,起始甲中充入0.2molNO和0.2molCO所达到的平衡状态是等效平衡,利用甲的反应三段式计算;C.根据乙的反应三段式计算平衡常数K,结合浓度商Qc与K的关系判断反应进行的方向;D.同比增大NO、CO的浓度,相当于加压,根据增大压强对化学平衡的影响分析判断。
(1)利用太阳能工艺可将Fe3O4转化为FeO,然后利用FeO捕获CO2可得炭黑,由流程图可知总反应为CO2![]() C+O2,在500℃条件下,过程2中CO2和FeO发生反应生成的Fe3O4是过程1中的反应物,所以该循环中Fe3O4可视为催化剂,过程2的反应为6FeO+CO2=2Fe3O4+C,C的化合价降低4,即转移4e-,所以捕获1mo1CO2转移电子的物质的量为4mol,故答案为:催化剂;4;
C+O2,在500℃条件下,过程2中CO2和FeO发生反应生成的Fe3O4是过程1中的反应物,所以该循环中Fe3O4可视为催化剂,过程2的反应为6FeO+CO2=2Fe3O4+C,C的化合价降低4,即转移4e-,所以捕获1mo1CO2转移电子的物质的量为4mol,故答案为:催化剂;4;
(2)CO2(g)与NH3(g)合成尿素的化学方程式为2NH3(g)+CO2(g)=CO(NH2)2(s) +H2O(l);①2NH3(g)+CO2(g)═H2NCOONH4(s) △H=-1595kJmol-1,②H2NCOONH4 (s)═CO(NH2)2(s)+H2O(g) △H=+1165kJmol-1,③H2O(l)═H2O(g) △H=+44.0kJmol-1,根据盖斯定律,将①+②-③得:2NH3(g)+CO2(g)=CO(NH2)2(s) +H2O(l) △H=-1595kJmol-1+(+1165kJmol-1) -(+44.0kJmol-1)=-474 kJmol-1,即2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=-474 kJmol-1 ,故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=-474 kJmol-1 ;
(3)A.反应达到平衡时,CO2和CH4的浓度不变,但不一定相等,所以该状态不能判定反应达到平衡状态,故A错误;B.反应达到平衡时v正(CO2)∶v逆(CO)=1∶2,即2v正(CO2)=v逆(CO),所以v正(CO2)=2v逆(CO)的状态不是平衡状态,实际上此时反应正向进行,故B错误;C.每断裂4molC-H键的同时,断裂2molH-H键,即2v正(CH4)=v逆(H2),符合v正(CH4)∶v逆(H2)=1∶2,说明正逆反应速率相等,为平衡状态,故C正确;D.反应体系中各物质均为气体,混合气体的总质量不变,气体总物质的量n是变化的,根据M=![]() 可知,容器中混合气体的平均相对分子质量保持不变的状态是平衡状态,故D正确;E.反应体系中各物质均为气体,混合气体的总质量不变,所以恒温恒容条件下容器中混合气体的密度ρ=
可知,容器中混合气体的平均相对分子质量保持不变的状态是平衡状态,故D正确;E.反应体系中各物质均为气体,混合气体的总质量不变,所以恒温恒容条件下容器中混合气体的密度ρ=![]() 始终保持不变,不能判定反应是否达到平衡状态,故E错误;故答案为:CD;
始终保持不变,不能判定反应是否达到平衡状态,故E错误;故答案为:CD;
(4)A.将甲的平衡状态升温到100℃时,n(CO2)减少,说明升高温度,平衡逆向移动,正反应放热,故A错误;
B.

50℃时,若起始甲中充入0.1molN2和0.2molCO2达到的平衡状态与起始甲中充入0.2molNO和0.2molCO所达到的平衡状态是等效平衡,即达到平衡状态时c(N2)=0.03mol/L,n(N2)=0.06mol,所以达平衡时N2的转化率=![]() ×100%=40%,故B正确;
×100%=40%,故B正确;
C.100℃时,

平衡常数K=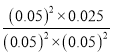 =10,若起始时向乙中充入的NO、CO、N2和CO2均为0.40mol,即浓度均为0.2mol/L时,浓度商Qc=
=10,若起始时向乙中充入的NO、CO、N2和CO2均为0.40mol,即浓度均为0.2mol/L时,浓度商Qc=![]() =5<10=K,所以反应正向进行,此时v正>v逆,故C正确;
=5<10=K,所以反应正向进行,此时v正>v逆,故C正确;
D.反应2NO(g)+2CO(g)N2(g)+2CO2(g)正向气体体积减小,增大压强时平衡正向移动,c(CO2)增大,丙容器反应体系相当于乙容器加压,平衡正向移动,c(CO2)增大,所以达到平衡时,丙中CO2的体积分数比乙中的大,故D错误;故答案为:BC。

【题目】根据下列实验操作和现象所做出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 相同条件下,浓度均为1mol·L1的CH3COOH和HCl分别做导电性实验,CH3COOH溶液对应的灯泡较暗 | CH3COOH是弱电解质 |
B | 向浓度均为0.1 mol·L1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2]<Ksp[Cu(OH)2] |
C | 分别向pH=3的盐酸和草酸溶液中加入足量锌粒,一段时间后草酸反应速率更快 | 草酸是二元酸 |
D | 室温下,用pH试纸测得:0.1 molL-1 Na2SO3溶液的pH为10;0.1 molL-1 NaHSO3溶液pH为5 | HSO |
A.AB.BC.CD.D
【题目】我国《食品添加剂使用卫生标准》中规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中的SO2,并对其含量进行测定。
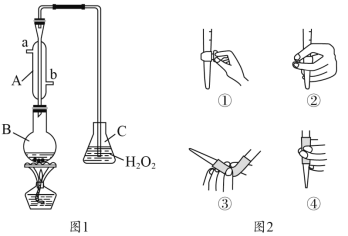
(1)仪器B的名称是__________,冷却水的进口为________。(填“a”或“b”)
(2)B中加入300.00mL葡萄酒和适量硫酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为______________________________________________。
(3)除去C中过量的H2O2,然后用0.1000mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若选择酚酞为指示剂,则滴定终点的现象为_____________________;
(4)经3次平行实验,消耗NaOH溶液体积如下:
序号 | 滴定前读数 | 滴定后读数 |
1 | 0.00 | 20.01 |
2 | 1.00 | 20.99 |
3 | 0.00 | 21.10 |
该葡萄酒中SO2含量为______________g·L-1(保留两位小数)。