题目内容
【题目】按照如图所示的操作步骤,完成铝与盐酸反应的实验。
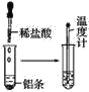
回答下列问题:
(1)实验过程中观察到的实验现象是__。
(2)写出铝与盐酸反应的离子方程式__。
(3)该反应是放热反应还是吸热反应__。
【答案】加入盐酸产生大量气泡,温度计指示温度升高 2Al+6H+=2Al3++3H2↑ 放热反应
【解析】
铝与盐酸反应产生大量气泡,由于该反应是放热反应,温度计指示的温度升高。
(1)铝与盐酸反应产生大量气泡,是放热反应,实验过程中观察到的实验现象是加入盐酸产生大量气泡,温度计指示温度升高。故答案为:加入盐酸产生大量气泡,温度计指示温度升高;
(2)铝与盐酸反应生成氯化铝和氢气,离子方程式2Al+6H+=2Al3++3H2↑ 。故答案为:2Al+6H+=2Al3++3H2↑;
(3)活泼金属与酸的反应是放热反应。故答案为:放热反应。

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目