题目内容
【题目】某高分子化合物M的合成路线如下:回答下列问题:

已知:![]() (R表示饱和烃基)。
(R表示饱和烃基)。
(1)A→B的反应类型是_________________。H→J的反应类型是_________________
(2)C→D的反应条件为___________________。
(3)E可以使溴的四氯化碳溶液褪色,则E的系统命名是_____________________。
(4)设计反应G→H和J→K的目的是__________________。
(5)H有两种可能的结构,为了确定其结构可选用的仪器是________(填代号)。
a.红外光谱仪 b.质谱仪 c.元素分析仪 d.核磁共振仪
(6)高分子化合物M的单体为____________________ (写结构简式)。
(7)J→K的化学方程式为______________________。
(8)与L具有相同官能团的L的同分异构体还有_____种,(不包括立体异构和L本身)其中核磁共振氢谱为3组峰,且面积比为3:2:1的是_____________(写结构简式)。
【答案】 加成反应 氧化反应 浓硫酸、加热 2-甲基-1,3-丁二烯 保护碳碳双键不被氧化 ad 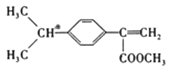 、
、![]()
 4
4 
【解析】高聚物M 由D和L在催化剂的作用下生成,可推出D、L为
由D和L在催化剂的作用下生成,可推出D、L为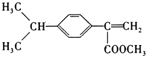 、
、![]() ,E(C5H8)最终转化成L,所以L为
,E(C5H8)最终转化成L,所以L为![]() ,D为
,D为 ,A为(C3H6)和苯环(C6H6)反应生成B(C9H12)为加成反应,则A为CH3CH=CH2,B为
,A为(C3H6)和苯环(C6H6)反应生成B(C9H12)为加成反应,则A为CH3CH=CH2,B为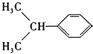 ,B与
,B与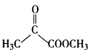 反应生成C,C为
反应生成C,C为 ,C到D为醇的消去,L为
,C到D为醇的消去,L为![]() ,K酸化得到L,K为J消去得到,所以K为
,K酸化得到L,K为J消去得到,所以K为![]() ,根据R-CH2OH
,根据R-CH2OH![]() R-COOH结合H反应生成J的条件可知:J为HOOCCH2C(CH3)BrCOOH,H为HOCH2CH2C(CH3)BrCH2OH,据此逐步推出,G为HOCH2CH2=CH(CH3)CH2OH,F为BrCH2CH2=CH(CH3)CH2Br,E为CH2=C(CH3)-CH=CH2。
R-COOH结合H反应生成J的条件可知:J为HOOCCH2C(CH3)BrCOOH,H为HOCH2CH2C(CH3)BrCH2OH,据此逐步推出,G为HOCH2CH2=CH(CH3)CH2OH,F为BrCH2CH2=CH(CH3)CH2Br,E为CH2=C(CH3)-CH=CH2。
(1)A→B的反应:CH3CH=CH2+![]()
![]()
 ,属于加成反应,H→J的反应条件数酸性高锰酸钾,因此属于氧化反应,故答案为:加成反应;氧化反应;
,属于加成反应,H→J的反应条件数酸性高锰酸钾,因此属于氧化反应,故答案为:加成反应;氧化反应;
(2)C→D为醇的消去,反应条件为浓硫酸、加热,故答案为:浓硫酸、加热;
(3)E为CH2=C(CH3)-CH=CH2,主链含有4个碳,1,3号碳上含有双键,2号碳上含有甲基,所以系统命名是2-甲基-1,3-丁二烯,故答案为:2-甲基-1,3-丁二烯;
(4)G→H:HOCH2CH2=CH(CH3)CH2OH+HBr→HOCH2CH2C(CH3)BrCH2OH,J→K:HOOCCH2C(CH3)BrCOOH![]()
![]() ,由此可见G→H和J→K的目的是保护碳碳双键不被氧化,故答案为:保护碳碳双键不被氧化;
,由此可见G→H和J→K的目的是保护碳碳双键不被氧化,故答案为:保护碳碳双键不被氧化;
(5)H为HOCH2CH2C(CH3)BrCH2OH,H有两种能的结构,确定其结构,a.红外光谱仪用于检测有机物中特殊官能团及机构特征,主要适用于定性分析有机化合物结构,故选;b.质谱仪能测出有机物相对分子质量,与结构无关,故不选;c.元素分析仪来确定有机化合物中的元素组成,不符合题意,故不选;d.核磁共振仪能测出有机物中氢原子子的种类以及数目之比,与结构有关,故选;故答案为:ad;
(6)高分子化合物M ,为加聚反应的产物,所以单体为
,为加聚反应的产物,所以单体为 、
、![]() , 故答案为:
, 故答案为: 、
、![]() ;
;
(7)J→K,为卤代烃的消去,反应为: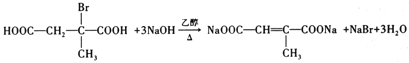 或
或 ,故答案为:
,故答案为: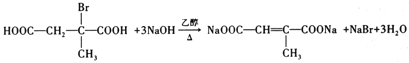 或
或 ;
;
(8)L为![]() ,具有相同官能团的L的同分异构体还有
,具有相同官能团的L的同分异构体还有![]() 、
、![]() 、
、 、
、![]() 共4种,其中核磁共振氢谱为3组峰,且面积比为3:2:1的是
共4种,其中核磁共振氢谱为3组峰,且面积比为3:2:1的是![]() ,故答案为:4;
,故答案为:4;![]() 。
。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液b.CH3COONa 溶液c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”);
(3)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-4 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=_________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为__________________。
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和 。
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol/L NaOH溶液对20.00 mL醋酸溶液进行滴定(酚酞作指示剂),几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(ml) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为 mol/L。(保留小数点后四位)
(3)判断滴定终点的方法是 。
(4)下列操作中可能使所测醋酸溶液的浓度数值偏低的是 (填字母序号)。
A.碱式滴定管未用标准液润洗就直接注入标准液
B.滴定前盛放醋酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.量取醋酸体积时,开始俯视读数,滴定结束时仰视读数
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 |
(5)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是 。




