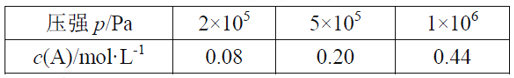题目内容
【题目】现有可逆反应2NO2(g) ![]() N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措(只改变一种外部条件)。
N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措(只改变一种外部条件)。
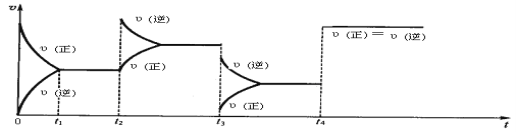
t2:___________________;t3:______________________ ;t4:______________________。
已知:A(g) + 2B(g) ![]() 2C(g) ΔH < 0。此反应的平衡常数表达式K=__________,温度降低,
2C(g) ΔH < 0。此反应的平衡常数表达式K=__________,温度降低,
K值会______(增大、减小、不变),A的转化率______________,化学反应速率________________。
【答案】t2:增大四氧化二氮浓度t3:压强减小t4:使用了催化剂K=c2(C)/[c(A)·c2(B)]增大升高减小
【解析】
试题t2:正反应速率瞬间不变,逆反应速率增大,然后逆反应速率逐渐减小,说明增大四氧化二氮浓度,平衡逆向移动;t3:正逆反应速率都减小,平衡逆向移动,则结合方程式分析,改变的条件为压强减小;t4:正逆反应速率同等程度的增大,平衡不移动,说明使用了催化剂 。根据平衡常数表达式分析,平衡常数K=c2(C)/ [ c(A)·c2(B) ] ;温度降低,平衡正向移动,平衡常数增大,A的转化率升高,反应速率都减小。

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
【题目】室温下,如图为用一定物质的量浓度的NaOH溶液Y滴定10 mL一定物质的量浓度的盐酸X的图象,依据图象推出X和Y的物质的量浓度是下表内各组中的

A | B | C | D | |
X/mol·L-1 | 0.12 | 0.09 | 0.04 | 0.03 |
Y/mol·L-1 | 0.04 | 0.03 | 0.12 | 0.09 |
A. A B. B C. C D. D