题目内容
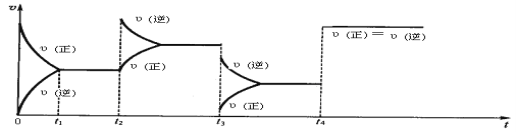
【题目】如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为

A. 7∶2
B. 5∶4
C. 3∶5
D. 2∶7
【答案】A
【解析】
反应前左右压强都相等,气体的物质的量之比等于体积之比,令空气的物质的量为1mol,则氢气、氧气的混合气体为3mol。反应后恢复至原来的温度,活塞正好停留在容器的中间,说明反应后左右气体的物质的量相等,右室中剩余气体为1mol;若剩余的气体为H2,参加反应气体共2mol,由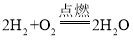 可知,O2有2mol×
可知,O2有2mol×![]() =
=![]() mol,故H2有3mol-
mol,故H2有3mol-![]() mol=
mol=![]() mol,故H2、O2的体积比7:2;若剩余的气体为O2,参加反应气体共2mol,H2有2mol×
mol,故H2、O2的体积比7:2;若剩余的气体为O2,参加反应气体共2mol,H2有2mol×![]() =
=![]() mol,故O2有3mol-
mol,故O2有3mol-![]() mol =
mol =![]() mol,故H2、O2的体积比4:5;故答案选A。
mol,故H2、O2的体积比4:5;故答案选A。

 优加精卷系列答案
优加精卷系列答案【题目】(1)现有下列4种物质:①NO、②Cl2、③浓H2SO4、④NH4HCO3。其中,受热易分解的是______________;(填序号,下同);可作氧气干燥剂的是______________;属于氧化物的是______________。
(2)选择装置,完成实验。
|
|
|
A | B | C |
①用CCl4萃取碘水中的I2,选用_________________(填序号,下同)。
②配制100 mL 0.50 mol/L NaOH溶液,选用_________________。
③从NaCl溶液中获取NaCl固体,选用____________________。
【题目】在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)