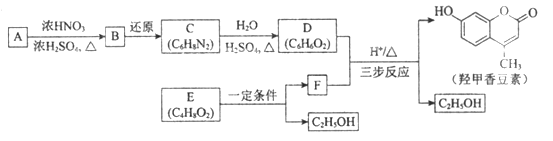
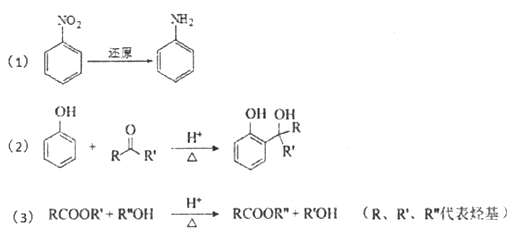
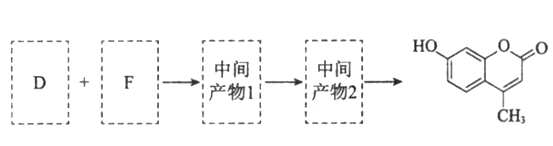
题目内容
【题目】如图有关图示分析正确的是( )
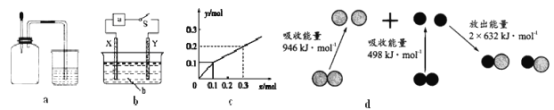
A. 如图a所示,集气瓶内充満Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,焼杯中的水会迸入集气瓶,并可能充满集气瓶
B. 如图b所示,X为铁棒,Y为铜棒,M为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入M
C. Pt内电极, 电解含0.10 mol M+和0.1 molN3+ (M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+
D. 图d为N2(g)和O2(g)生成NO(g)过程中的能量変化,则N-N的键能为946kJ·mol-1,其热化学方程式为N2(g)+O2(g)=2NO(g) △H=-180 kJ·mol-1
【答案】B
【解析】A.生成的一氯甲烷不溶于水;B.X为铁棒,X极附近产生白色沉淀时,可以知道Fe为阳极失去电子,电子从负极流向正极;C.通过0.2mol 电子时生成0.1molY,则应该是氢离子放电,而N3+不放电,氧化性最弱;D.由图可以知道,反应热=946+498-2×632=180 kJ·mol-1;以此来解答。
因为甲烷与氯气的反应中可能产生一氯甲烷气体,而一氯甲烷不溶于水,则水不可能充满集气瓶,A错误;X极附近产生白色沉淀,这说明X电极是铁电极,与电源的正极相连,作阳极失去电子转化为亚铁离子,因此电子从X极流入a,B正确;根据图象可以知道通过0.10mol电子时产生0.1molY,这说明应该是M+放电.再通过0.2 mol电子时生成0.1molY,则应该是氢离子放电,所以离子氧化能力M+>N3+>H+,C错误;图d为N2(g)和O2(g)生成NO(g)过程中的能量変化,氮气含有三键,键能大于氧气中键能,则N≡N的键能为946kJ·mol-1,反应热=946+498-2×632=180 kJ·mol-1,所以热化学方程式为N2(g)+O2(g)=2NO(g)△H=+180kJ·mol-1,D错误;正确选项B。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】在2L恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) ![]() 2C(g)+D(s),所得实验数据如下表:
2C(g)+D(s),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 600 | 0.30 | 0.20 | 0.30 |
② | 700 | 0.20 | 0.30 | 0.24 |
③ | 800 | 0.10 | 0.10 | a |
下列说法不正确的是
A. 实验①中,若5min时测得n(B)=0.050mol,则0至5min时间内平均反应速率v(A)=0.015mol/(L·min)
B. 实验②中达到平衡后,增大压强,A的转化率不变,平衡常数不变
C. 700℃时该反应的平衡常数K=4.0
D. 实验③中,达到平衡时,a>0.10