题目内容
【题目】Ⅰ.(1)某短周期元素组成的分子的球棍模型如图所示。已知分子中所有原子的最外层均达到8电子稳定结
构,原子间以单键相连。下列有关说法中错误的是(________)
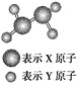
A.X原子可能为ⅤA族元素
B.Y原子一定为ⅠA族元素
C.该分子中,既含极性键,又含非极性键
D.从圆球的大小分析,该分子可能为N2F4
(2)若上述模型中Y原子最外层达到2电子稳定结构且其相对分子质量与O2相同,则该物质的分子式为______________,它与P2H4常温下均为气体,但比P2H4易液化,常用作火箭燃料,其主要原因是______________________________________________________________________。
Ⅱ.已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键,试推断:
(1)X、Z两种元素的元素符号:X___________________________________________、
Z______________________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________,它的共价键属于________(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为________;含有极性共价键和非极性共价键的化合物的电子式为________________________________。
(3)由X、Y、Z所形成的常见离子化合物是__________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为___________________________________________________________________________________________;
X与W形成的化合物与水反应时,水是_____________________________________
(填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成W2Z的过程: __________________________________________________________________________。
【答案】BN2H4N2H4分子之间形成氢键,致使N2H4沸点升高易液化HO![]() 极性
极性![]()
![]() NH4NO3 NH
NH4NO3 NH![]() +OH-
+OH-![]() NH3↑+H2O氧化剂
NH3↑+H2O氧化剂![]()
【解析】
Ⅰ.(1)根据球棍模型可知,该物质的电子式为![]() ,所以X为第ⅤA族元素,Y为第ⅦA族元素,故B错误,答案选B;
,所以X为第ⅤA族元素,Y为第ⅦA族元素,故B错误,答案选B;
(2)由于Y为H元素,所以该物质的分子式为N2H4,N2H4分子之间形成氢键,使N2H4沸点升高易液化,故答案为:N2H4;N2H4分子之间形成氢键,致使N2H4沸点升高易液化;
Ⅱ.(1)根据已知条件可以推断,Z为O,Y为N,W为Na,X为H,故答案为:H、O;
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物是氨气,氨气的电子式为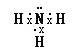 ,氮原子和氢原子之间的共价键是极性键;含有离子键和非极性共价键的化合物为过氧化钠,过氧化钠的电子式为
,氮原子和氢原子之间的共价键是极性键;含有离子键和非极性共价键的化合物为过氧化钠,过氧化钠的电子式为![]() ;含有极性共价键和非极性共价键的化合物是双氧水或N2H4,其电子式为
;含有极性共价键和非极性共价键的化合物是双氧水或N2H4,其电子式为![]() 或
或![]() 故答案为:
故答案为: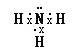 ;极性;
;极性;![]() ;
;![]() 或
或![]() ;
;
(3)NH4NO3是离子化合物,NH4NO3与浓NaOH加热时发生反应:NH![]() +OH-
+OH-![]() NH3↑+H2O;NaH和H2O反应生成NaOH和H2,H2O是氧化剂,故答案为:NH4NO3、NH
NH3↑+H2O;NaH和H2O反应生成NaOH和H2,H2O是氧化剂,故答案为:NH4NO3、NH![]() +OH-
+OH-![]() NH3↑+H2O、氧化剂;
NH3↑+H2O、氧化剂;
(4)钠和氧气反应生成氧化钠,该反应中钠失电子发生氧化反应,氧气得电子发生还原反应,其反应过程为![]() ,故答案为:
,故答案为:![]() 。
。

 名校课堂系列答案
名校课堂系列答案