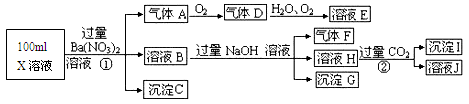
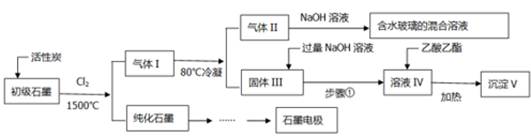
题目内容
(8分)写出下列反应的离子方程式
(1)含少量NaHCO3的溶液与含过量Ba(OH)2的溶液混合: ;
(2)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式 ;
(3)硫酸铜溶液和氢氧化钡溶液混合
(4)用醋酸除去水壶中的水垢
(1)HCO3-+OH-+Ba2+===BaCO3↓+H2O
(2)2H++SO42—+2OH-+Ba2+===BaSO3↓+2H2O
(3)Cu2++SO42—+2OH-+Ba2+===BaSO3↓+Cu(OH)2↓;
(4)CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O
解析试题分析:(1)含少量NaHCO3的溶液与含过量Ba(OH)2的溶液混合,“以少定多”;即用HCO3-定Ba2+和OH-的计量数:HCO3-+OH-+Ba2+===BaCO3↓+H2O。
(2)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,Ba(OH)2做标准,即Ba2++2OH-定H+和Ba2+的计量数:2H++SO42—+2OH-+Ba2+===BaSO3↓+2H2O;
(3)硫酸铜溶液和氢氧化钡溶液混合只有:Cu2++SO42—+2OH-+Ba2+===BaSO3↓+Cu(OH)2↓;
(4)醋酸是弱酸,不能拆开,水壶中的水垢主要为CaCO3固体。
考点:离子方程式的书写。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案下列各组离子在溶液中能够大量共存的是
| A.NH4+、Ca2+、OHˉ、CO32ˉ |
| B.Ag+、H+、SO32ˉ、ClOˉ |
| C.NH4+、Brˉ、Na+、SO42ˉ |
| D.H+、Clˉ、Fe2+、NO3ˉ |
下列离子能够大量共存,且满足相应要求的是
| 选项 | 离 子 | 要 求 |
| A | NH、Al3+、SO、H+ | 滴加NaOH溶液立刻有气体产生 |
| B | K+、NO、Cl-、HS- | c(K+)<c(Cl-) |
| C | Fe2+、NO、SO、Cl- | 逐滴滴加盐酸时溶液没有颜色变化 |
| D | Na+、HCO、Mg2+、SO | 滴加氨水立即有沉淀产生 |
(18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能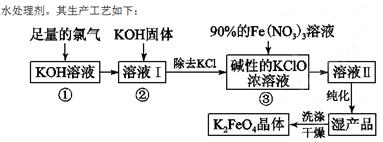
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(2)在溶液Ⅰ中加入KOH固体的目的是 (填编号)。
| A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为KClO |
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
___FeO
 +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
Ⅰ.高铁酸钾(K2FeO4)是极好的氧化剂,具有高效的消毒作用,为一种新型非氯高效消毒剂。其生产工艺流程如下: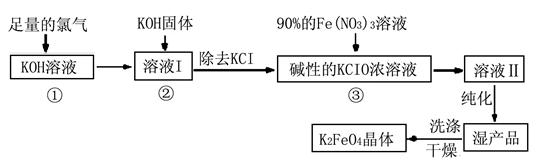
请同答下列问题。
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式 。
(2)在溶液I中加入KOH固体的目的是 (选填序号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解会放出较多的热量,有利于提高反应速率和KClO的纯度 |
(4)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH
 3Zn+2K2FeO4+8H2O,
3Zn+2K2FeO4+8H2O,放电时电池的负极反应式为 。
Ⅱ.肼(N2H4)又称联氨,是一种可燃性的液体,用作火箭燃料。
(5)写出肼分子的电子式 。
(6)肼能与N2O4反应:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ/mol。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol, 写出肼与O2反应生成N2和H2O(g)的热化学方程式 。