题目内容
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) △H=a kJ mol-1 。
O2(g) △H=a kJ mol-1 。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H=-92.4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
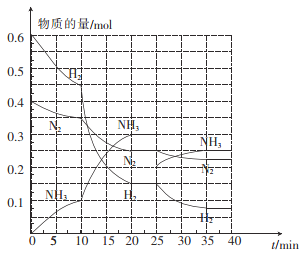
① 0~10 min内,以NH3表示的平均反应速率为_________。
② 在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 在反应进行至25 min时,曲线发生变化的原因是____________,达到第二次平衡时,新平衡的平衡常数K2______K1(填“>”“<”或“ = ”)
【答案】(1)> ;>
(2)①0.005 mol L-1 min-1
②BC
③移走 0.1 molNH3 ; =
【解析】
试题分析:(1)升高温度NH3的物质的量最多,所以N2(g)+3H2O(l) ![]() 2NH3(g)+
2NH3(g)+![]() O2反应吸热,a>0;反应后气体物质的量增多,△S>0;(2)① 0~10 min内,以NH3表示的平均反应速率为
O2反应吸热,a>0;反应后气体物质的量增多,△S>0;(2)① 0~10 min内,以NH3表示的平均反应速率为![]()
![]() 0.005 mol L-1 min-1;② 在10~20 min内,NH3浓度逐渐增大,变化的原因可能是A.加入催化剂,平衡不移动,NH3物质的量不变,A错误; B.缩小容器体积,平衡正向移动,氨气的物质的量增大,B正确 ; C.降低温度,平衡正向移动,NH3物质的量增大,C正确; D.增加NH3的物质的量,平衡逆向移动,氮气、氢气增多,D错误;③ 在反应进行至25 min时,氨气的物质的量突然由0.3mol变为0.2mol,曲线发生变化的原因是移走 0.1 molNH3,平衡常数只与温度有关,温度不变平衡常数不变,达到第二次平衡时,新平衡的平衡常数K2=K1。
0.005 mol L-1 min-1;② 在10~20 min内,NH3浓度逐渐增大,变化的原因可能是A.加入催化剂,平衡不移动,NH3物质的量不变,A错误; B.缩小容器体积,平衡正向移动,氨气的物质的量增大,B正确 ; C.降低温度,平衡正向移动,NH3物质的量增大,C正确; D.增加NH3的物质的量,平衡逆向移动,氮气、氢气增多,D错误;③ 在反应进行至25 min时,氨气的物质的量突然由0.3mol变为0.2mol,曲线发生变化的原因是移走 0.1 molNH3,平衡常数只与温度有关,温度不变平衡常数不变,达到第二次平衡时,新平衡的平衡常数K2=K1。

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为 .
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液. ①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论: .
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是(填字母序号).
a.溶液温度下降b.溶液温度升高c.滴入酚酞后呈浅红色d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中. 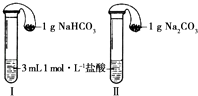
①两试管中均产生气体,(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是(填字母序号).
a.装置Ⅰ的气球体积较大b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5molL﹣1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2mL Na2CO3溶液中滴加1mL 0.5molL﹣1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32﹣浓度较大,能与CaCl2发生反应:(写离子方程式) |
操作2:向2mL NaHCO3溶液中滴加1mL 0.5molL﹣1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32﹣浓度很小,不能与CaCl2反应 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为 .
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是__________________。
