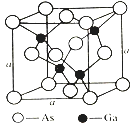
题目内容
【题目】将锌棒和铜棒插入西红柿中,电流表指针发生偏转,如图所示,下列说法正确的是( )

A. 负极反应为Zn-2e-==Zn2+
B. 该装置将化学能转化为电能
C. 电流由锌通过导线流向铜棒
D. 一段时间后,锌棒质量会增加
【答案】AB
【解析】该装置是能自发的进行氧化还原反应,能将化学能转化为电能,属于原电池,Zn易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,以此解答该题。
Zn易失电子作负极、Cu作正极,则
A、锌棒是负极,负极反应式为Zn-2e-=Zn2+,A正确;
B、该装置是能自发的进行氧化还原反应,能将化学能转化为电能,属于原电池,B正确;
C、Zn易失电子作负极、Cu作正极,电流由铜通过导线流向锌棒,C错误;
D、锌棒是负极,负极反应式为Zn-2e-=Zn2+,锌棒质量减小,D错误;答案选AB。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
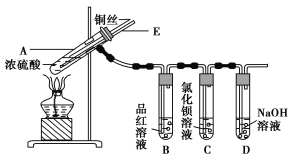
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为____________________________________________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_______________________________。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 | ________ | ________ |
写出其SO2表现还原性的离子反应方程式:______________________________________。
(4) 装置D的作用__________________________________________________________ 。
(5)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是_________________________________________________________________。