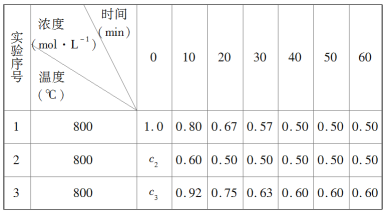
题目内容
【题目】化学上常用AG 表示溶液中的酸碱度,AG=lg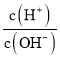 。25℃时,用0.100mol·L-1的NaOH 溶液滴定20.00mL 0.100mol·L-1HNO2溶液,AG与所加NaOH 溶液的体积(V)关系如图所示,下列说法正确的是( )
。25℃时,用0.100mol·L-1的NaOH 溶液滴定20.00mL 0.100mol·L-1HNO2溶液,AG与所加NaOH 溶液的体积(V)关系如图所示,下列说法正确的是( )
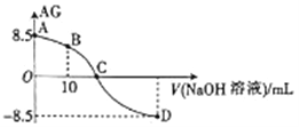
A. B点溶液中存在c(H+)-c(OH-)=c(NO2-)-c(HNO2)
B. D点溶液中的pH=11.25
C. C点时,加入NaOH 溶液的体积为20.00 mL
D. 25 ℃时,HNO2 的电离平衡常数Ka=1.0×10-5.5
【答案】B
【解析】B点是10mL 0.100mol·L-1的NaOH溶液与20.00mL0.100mol·L-1HNO2溶液混合,溶质为等浓度的NaNO2和HNO2;根据电荷守恒,c(H+)+ c(Na+)= c(NO2-)+ c(OH-),根据物料守恒,2c(Na+)= c(NO2-)+c(HNO2),所以2c(H+)-2c(OH-)=c(NO2-)-c(HNO2),故A错误;D点溶液的AG=-8.5,说明中 =10-8.5,所以c(H+)=10-11.25,pH=11.25,故B正确;A点溶液AG=8.5,说明中
=10-8.5,所以c(H+)=10-11.25,pH=11.25,故B正确;A点溶液AG=8.5,说明中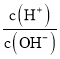 =108.5, c(H+)=10-2.75,pH=2.75,所以HNO2是弱酸,C点AG=0,溶液呈中性,所以加入NaOH溶液的体积小于20.00mL,故C错误; 根据C选项,0.100mol·L-1HNO2溶液c(H+)=10-2.75, 25℃时,HNO2的电离平衡常数Ka=
=108.5, c(H+)=10-2.75,pH=2.75,所以HNO2是弱酸,C点AG=0,溶液呈中性,所以加入NaOH溶液的体积小于20.00mL,故C错误; 根据C选项,0.100mol·L-1HNO2溶液c(H+)=10-2.75, 25℃时,HNO2的电离平衡常数Ka=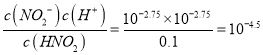 ,故D错误。
,故D错误。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目