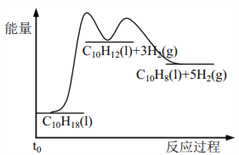
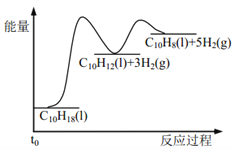
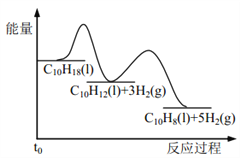
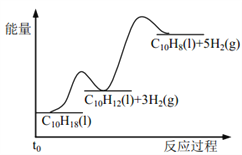
题目内容
【题目】对于反应COCl2(g)![]() CO(g)+Cl2(g) △H>0。改变下列条件,能加快反应速率,且CO物质的量分数增大的是
CO(g)+Cl2(g) △H>0。改变下列条件,能加快反应速率,且CO物质的量分数增大的是
A. 恒容下通入He B. 恒容下增大COCl2浓度 C. 升温 D. 加催化剂
【答案】C
【解析】A、恒容下通入惰性气体,各物质的浓度不变,反应速率不变,故A错误;B、增大COCl2浓度,单位体积活化分子数目增多,反应速率增大;平衡向正向移动,CO浓度增大;由于正反应是一个气体数目增多的反应,恒容下增大COCl2的浓度,体系的压强增大,COCl2的转化率减小,使得COCl2的质量分数增大,CO的质量分数减小,故B错误;C、升高温度,任何反应速率均加快,平衡向右移动,CO的质量分数增大,故C正确;D、加催化剂加快反应速率,但不能改变平衡转化率,CO的质量分数不改变,故D错误。故选C。

【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) △H="a" kJ mol-1。
O2(g) △H="a" kJ mol-1。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。

① 0~10 min内,以NH3表示的平均反应速率为_________。
② 在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 在反应进行至25 min时,曲线发生变化的原因是____________,达到第二次平衡时,新平衡的平衡常数K2______K1(填“>”“<”或“ = ”)