题目内容
X、Y、Z、W都是中学化学中常见物质,其中X、Y、Z 均含有同一种元素,在一定条件下相互转化关系如图1(部分生成物已略去).
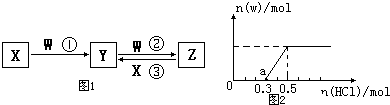
(1)若X、W均为单质,且X为气体,Y的水溶液中滴入KSCN溶液后变红.
ⅰ)反应③的离子方程式是 ;
ⅱ)Y的水溶液显酸性,原因是(用离子方程式表示) ;将Y溶液蒸干、灼烧,得到的固体物质是 .
(2)若X为氯碱工业的产品之一,Y为工业上生产普通玻璃的一种原料.
Ⅰ、氯碱工业中制备X的化学方程式是 .
Ⅱ、先将一定量的W气体通入到300mL X的溶液中,再在所得溶液中逐滴加入稀盐酸至过量,产生的气体与反应的HCl两者物质的量的关系如图2所示(气体的溶解和HCl的挥发忽略):
ⅰ)O点溶液中所含溶质的化学式为 ;
ⅱ)a点溶液中H+和OH-浓度的大小关系为 ;
ⅲ)标准状况下,通入气体W的体积为 .

(1)若X、W均为单质,且X为气体,Y的水溶液中滴入KSCN溶液后变红.
ⅰ)反应③的离子方程式是
ⅱ)Y的水溶液显酸性,原因是(用离子方程式表示)
(2)若X为氯碱工业的产品之一,Y为工业上生产普通玻璃的一种原料.
Ⅰ、氯碱工业中制备X的化学方程式是
Ⅱ、先将一定量的W气体通入到300mL X的溶液中,再在所得溶液中逐滴加入稀盐酸至过量,产生的气体与反应的HCl两者物质的量的关系如图2所示(气体的溶解和HCl的挥发忽略):
ⅰ)O点溶液中所含溶质的化学式为
ⅱ)a点溶液中H+和OH-浓度的大小关系为
ⅲ)标准状况下,通入气体W的体积为
分析:X、Y、Z、W都是中学化学中常见物质,其中X、Y、Z 均含有同一种元素,
(1)若X、W均为单质,且X为气体,Y的水溶液中滴入KSCN溶液后变红,W为Fe,X为Cl2,Y为FeCl3,Z为FeCl2;
(2)若X为氯碱工业的产品之一,Y为工业上生产普通玻璃的一种原料,X为NaOH,W为CO2,Y为Na2CO3,Z为NaHCO3,
I、电解饱和食盐水制备NaOH;
Ⅱ、ⅰ)Na2CO3跟盐酸的反应是分步进行的:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,由图象可知生成二氧化碳消耗的HCl的物质的量小于从反应到开始产生二氧化碳阶段消耗的HCl,故W与X反应后溶液中溶质为NaOH、Na2CO3;
ⅱ)a点溶液中溶质为NaHCO3、NaCl;
ⅲ)由NaHCO3+HCl=NaCl+H2O+CO2↑及消耗HCl计算.
(1)若X、W均为单质,且X为气体,Y的水溶液中滴入KSCN溶液后变红,W为Fe,X为Cl2,Y为FeCl3,Z为FeCl2;
(2)若X为氯碱工业的产品之一,Y为工业上生产普通玻璃的一种原料,X为NaOH,W为CO2,Y为Na2CO3,Z为NaHCO3,
I、电解饱和食盐水制备NaOH;
Ⅱ、ⅰ)Na2CO3跟盐酸的反应是分步进行的:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,由图象可知生成二氧化碳消耗的HCl的物质的量小于从反应到开始产生二氧化碳阶段消耗的HCl,故W与X反应后溶液中溶质为NaOH、Na2CO3;
ⅱ)a点溶液中溶质为NaHCO3、NaCl;
ⅲ)由NaHCO3+HCl=NaCl+H2O+CO2↑及消耗HCl计算.
解答:解:X、Y、Z、W都是中学化学中常见物质,其中X、Y、Z 均含有同一种元素,
(1)若X、W均为单质,且X为气体,Y的水溶液中滴入KSCN溶液后变红,W为Fe,X为Cl2,Y为FeCl3,Z为FeCl2;
ⅰ)反应③的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
ⅱ)铁离子水解显酸性,水解离子反应为Fe3++3H2O?Fe(OH)3+3H+,盐酸易挥发,则Y溶液蒸干得到氢氧化铁,灼烧后得到的固体物质Fe2O3,
故答案为:Fe3++3H2O?Fe(OH)3+3H+;Fe2O3;
(2)若X为氯碱工业的产品之一,Y为工业上生产普通玻璃的一种原料,X为NaOH,W为CO2,Y为Na2CO3,Z为NaHCO3,
I、电解饱和食盐水制备NaOH,该反应为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
Ⅱ、ⅰ)Na2CO3跟盐酸的反应是分步进行的:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,由图象可知生成二氧化碳消耗的HCl的物质的量小于从反应到开始产生二氧化碳阶段消耗的HCl,故W与X反应后溶液中溶质为NaOH、Na2CO3,故答案为:NaOH、Na2CO3;
ⅱ)a点溶液中溶质为NaHCO3、NaCl,碳酸氢根离子水解显碱性,则c(H+)<c(OH-),故答案为:c(H+)<c(OH-);
ⅲ)由图可知,a点时开始生成气体,故发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,至生成二氧化碳体积最大时,该阶段消耗的HCl的物质的量为0.2mol,由方程式可知产生二氧化碳的物质的量为0.2mol,生成的二氧化碳的物质的量等于开始通入的二氧化碳的物质的量,故开始通入的二氧化碳的体积为0.2mol×22.4L/mol=4.48L,
故答案为:4.48L.
(1)若X、W均为单质,且X为气体,Y的水溶液中滴入KSCN溶液后变红,W为Fe,X为Cl2,Y为FeCl3,Z为FeCl2;
ⅰ)反应③的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
ⅱ)铁离子水解显酸性,水解离子反应为Fe3++3H2O?Fe(OH)3+3H+,盐酸易挥发,则Y溶液蒸干得到氢氧化铁,灼烧后得到的固体物质Fe2O3,
故答案为:Fe3++3H2O?Fe(OH)3+3H+;Fe2O3;
(2)若X为氯碱工业的产品之一,Y为工业上生产普通玻璃的一种原料,X为NaOH,W为CO2,Y为Na2CO3,Z为NaHCO3,
I、电解饱和食盐水制备NaOH,该反应为2NaCl+2H2O
| ||
| ||
Ⅱ、ⅰ)Na2CO3跟盐酸的反应是分步进行的:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,由图象可知生成二氧化碳消耗的HCl的物质的量小于从反应到开始产生二氧化碳阶段消耗的HCl,故W与X反应后溶液中溶质为NaOH、Na2CO3,故答案为:NaOH、Na2CO3;
ⅱ)a点溶液中溶质为NaHCO3、NaCl,碳酸氢根离子水解显碱性,则c(H+)<c(OH-),故答案为:c(H+)<c(OH-);
ⅲ)由图可知,a点时开始生成气体,故发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,至生成二氧化碳体积最大时,该阶段消耗的HCl的物质的量为0.2mol,由方程式可知产生二氧化碳的物质的量为0.2mol,生成的二氧化碳的物质的量等于开始通入的二氧化碳的物质的量,故开始通入的二氧化碳的体积为0.2mol×22.4L/mol=4.48L,
故答案为:4.48L.
点评:本题考查无机物的推断及混合物的计算,注意利用转化关系推断物质为解答的关键,II中注意从图象分析反应发生的情况,关键是根据图象判断溶液溶质的成分,题目难度中等.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目