题目内容
已知X,Y、Z、W都是短周期主族元素,它们的原子半径和化合价等性质如下表所示.
|
分析:W化合价为-1价,故W为第VIIA族元素;Z元素化合价为-2价,Z处于ⅤIA族,X化合价为+4、-4价,应为周期表第IVA族,Y的化合价为+5价,应为周期表第VA族元素,由于X、Y的原子半径与W、Z原子半径小,则X、Y应在第二周期,所以W、Z为第三周期,所以X为C元素,Y为N元素,Z为S元素,W为Cl元素,结合元素周期律知识解答该题.
解答:解:W化合价为-1价,故W为第VIIA族元素;Z元素化合价为-2价,Z处于ⅤIA族,X化合价为+4、-4价,应为周期表第IVA族,Y的化合价为+5价,应为周期表第VA族元素,由于X、Y的原子半径与W、Z原子半径小,则X、Y应在第二周期,所以W、Z为第三周期,所以X为C元素,Y为N元素,Z为S元素,W为Cl元素,
A、C元素的氧化物CO,为中性氧化物,故A错误;
B、S元素的非金属性比Cl元素弱,所以S的最高价氧化物的水化物的酸性比Cl的弱,故B错误;
C、N的氢化物与Cl的氢化物反应的产物为氯化铵,含有离子键和共价键,故C错误;
D、C与S形成CS2时,其结构为:S=C=S,其中的各原子均满足8电子稳定结构,故D正确;
故选D.
A、C元素的氧化物CO,为中性氧化物,故A错误;
B、S元素的非金属性比Cl元素弱,所以S的最高价氧化物的水化物的酸性比Cl的弱,故B错误;
C、N的氢化物与Cl的氢化物反应的产物为氯化铵,含有离子键和共价键,故C错误;
D、C与S形成CS2时,其结构为:S=C=S,其中的各原子均满足8电子稳定结构,故D正确;
故选D.
点评:本题考查元素位置结构和性质的关系及应用,题目难度中等,从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,注意元素周期律的递变规律的应用.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
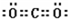
 已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)
已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)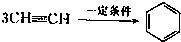 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式: