题目内容
X、Y、Z、W都是短周期主族元素,原子半径W>Z>X>Y.已知:X、Y两元素处于同一周期;X、Z处于同一主族;Z原子核内的质子数等于X、Y原子核内质子数之和;Z原子最外层上的电子数是W原子最外层上的电子数的4倍,同主族中W的原子半径最大.试回答:
(1)这四种元素单质(若有同素异形体只考虑熔点最高的)的熔点由高到低的顺序是(写化学式) .
(2)由这四种元素中某些元素组成的两种正盐的水溶液(均为0.1mol?L-1)的pH由大到小的顺序是(写化学式) .
(3)Y和Z两元素可形成化合物ZY2,某种ZY2晶体的结构相当于把金刚石中的原子均换成Z原子,再在每两个Z原子连线的中点放置一个Y原子,则此晶体中由Z、Y原子组成的最小环上共有Z原子 个,Y原子 个.
(1)这四种元素单质(若有同素异形体只考虑熔点最高的)的熔点由高到低的顺序是(写化学式)
(2)由这四种元素中某些元素组成的两种正盐的水溶液(均为0.1mol?L-1)的pH由大到小的顺序是(写化学式)
(3)Y和Z两元素可形成化合物ZY2,某种ZY2晶体的结构相当于把金刚石中的原子均换成Z原子,再在每两个Z原子连线的中点放置一个Y原子,则此晶体中由Z、Y原子组成的最小环上共有Z原子
分析:X、Y、Z、W都是短周期主族元素,原子半径W>Z>X>Y,且X、Y两元素处于同一周期,X、Z处于同一主族,则X、Y、Z三元素在周期表中的相对位置关系为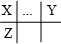 ,X、Y处在同一主族,二者质子数相差8,Z原子核内的质子数等于X、Y原子核内质子数之和,则Y的质子数为8,为氧元素;Z原子最外层上的电子数是W原子最外层上的电子数的4倍,则W最外层电子数为1、Z的最外层电子数为4,故X为碳元素、Z为Si元素;W最外层电子数为1,处于ⅠA族,同主族中W的原子半径最大,则W为Na元素,据此解答.
,X、Y处在同一主族,二者质子数相差8,Z原子核内的质子数等于X、Y原子核内质子数之和,则Y的质子数为8,为氧元素;Z原子最外层上的电子数是W原子最外层上的电子数的4倍,则W最外层电子数为1、Z的最外层电子数为4,故X为碳元素、Z为Si元素;W最外层电子数为1,处于ⅠA族,同主族中W的原子半径最大,则W为Na元素,据此解答.
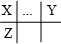 ,X、Y处在同一主族,二者质子数相差8,Z原子核内的质子数等于X、Y原子核内质子数之和,则Y的质子数为8,为氧元素;Z原子最外层上的电子数是W原子最外层上的电子数的4倍,则W最外层电子数为1、Z的最外层电子数为4,故X为碳元素、Z为Si元素;W最外层电子数为1,处于ⅠA族,同主族中W的原子半径最大,则W为Na元素,据此解答.
,X、Y处在同一主族,二者质子数相差8,Z原子核内的质子数等于X、Y原子核内质子数之和,则Y的质子数为8,为氧元素;Z原子最外层上的电子数是W原子最外层上的电子数的4倍,则W最外层电子数为1、Z的最外层电子数为4,故X为碳元素、Z为Si元素;W最外层电子数为1,处于ⅠA族,同主族中W的原子半径最大,则W为Na元素,据此解答.解答:解:X、Y、Z、W都是短周期主族元素,原子半径W>Z>X>Y,且X、Y两元素处于同一周期,X、Z处于同一主族,则X、Y、Z三元素在周期表中的相对位置关系为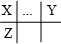 ,X、Y处在同一主族,二者质子数相差8,Z原子核内的质子数等于X、Y原子核内质子数之和,则Y的质子数为8,为氧元素;Z原子最外层上的电子数是W原子最外层上的电子数的4倍,则W最外层电子数为1、Z的最外层电子数为4,故X为碳元素、Z为Si元素;W最外层电子数为1,处于ⅠA族,同主族中W的原子半径最大,则W为Na元素,
,X、Y处在同一主族,二者质子数相差8,Z原子核内的质子数等于X、Y原子核内质子数之和,则Y的质子数为8,为氧元素;Z原子最外层上的电子数是W原子最外层上的电子数的4倍,则W最外层电子数为1、Z的最外层电子数为4,故X为碳元素、Z为Si元素;W最外层电子数为1,处于ⅠA族,同主族中W的原子半径最大,则W为Na元素,
(1)金刚石、晶体硅都为原子晶体,熔点最高,但金刚石中C-C键的键长比晶体硅中Si-Si键的键长短,故金刚石的熔点高于晶体硅,钠为金属晶体,常温下为固体,氧气常温下为气体,故熔点C(金刚石)>Si>Na>O2,
故答案为:C(金刚石)>Si>Na>O2;
(2)由四种元素中某些元素组成的两种正盐为Na2SiO3、Na2CO3,相同浓度水溶液中,由于碳酸的酸性强于硅酸,硅酸根的水解程度更大,故相同浓度水溶液pH由大到小的顺序是:Na2SiO3>Na2CO3,
故答案为:Na2SiO3>Na2CO3;
(3)Y和Z两元素可形成化合物为SiO2,某种SiO2晶体的结构相当于把金刚石中的原子均换成Si原子,再在每两个Si原子连线的中点放置一个O原子,由于金刚石中存在六元环,替换后得该种SiO2晶体的结构,则此晶体中由Si、O原子组成的最小环上共有6个Si原子、6个O原子,
故答案为:6;6.
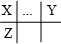 ,X、Y处在同一主族,二者质子数相差8,Z原子核内的质子数等于X、Y原子核内质子数之和,则Y的质子数为8,为氧元素;Z原子最外层上的电子数是W原子最外层上的电子数的4倍,则W最外层电子数为1、Z的最外层电子数为4,故X为碳元素、Z为Si元素;W最外层电子数为1,处于ⅠA族,同主族中W的原子半径最大,则W为Na元素,
,X、Y处在同一主族,二者质子数相差8,Z原子核内的质子数等于X、Y原子核内质子数之和,则Y的质子数为8,为氧元素;Z原子最外层上的电子数是W原子最外层上的电子数的4倍,则W最外层电子数为1、Z的最外层电子数为4,故X为碳元素、Z为Si元素;W最外层电子数为1,处于ⅠA族,同主族中W的原子半径最大,则W为Na元素,(1)金刚石、晶体硅都为原子晶体,熔点最高,但金刚石中C-C键的键长比晶体硅中Si-Si键的键长短,故金刚石的熔点高于晶体硅,钠为金属晶体,常温下为固体,氧气常温下为气体,故熔点C(金刚石)>Si>Na>O2,
故答案为:C(金刚石)>Si>Na>O2;
(2)由四种元素中某些元素组成的两种正盐为Na2SiO3、Na2CO3,相同浓度水溶液中,由于碳酸的酸性强于硅酸,硅酸根的水解程度更大,故相同浓度水溶液pH由大到小的顺序是:Na2SiO3>Na2CO3,
故答案为:Na2SiO3>Na2CO3;
(3)Y和Z两元素可形成化合物为SiO2,某种SiO2晶体的结构相当于把金刚石中的原子均换成Si原子,再在每两个Si原子连线的中点放置一个O原子,由于金刚石中存在六元环,替换后得该种SiO2晶体的结构,则此晶体中由Si、O原子组成的最小环上共有6个Si原子、6个O原子,
故答案为:6;6.
点评:本题考查元素推断、熔沸点比较、盐类水解、晶胞结构等,难度中等,推断元素是解题关键,(3)为易错点、难点,学生对金刚石晶胞晶体认识不全面,注意识记中学常见的晶胞结构.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目