题目内容
已知X、Y、Z、W都是短周期的非金属元素,其原子序数依次增大.W原子的质子数是Y原子质子数的两倍,X原子与W原子的最外层电子数之和是Y和Z原子的质子数之和的
.Y的氢化物分子中有三个共价键.
(1)X、Z的元素名称分别是 、 ,W元素原子结构示意图为 .
(2)Y的氢化物分子的空间构型为 ,属于 分子(填“极性”或“非极性”)
(3)由以上任意三种元素组成的化合物中,其水溶液显酸性的有(填写化学式) 、 .(任写两种)
(4)写出一个离子反应方程式,要求反应物与生成物的离子或分子均是由以上元素中的两种元素组成且各微粒所含的电子数相同. .
(5)我国材料学家已成功制备了W元素与Y元素组成的耐高温的新型材料W3Y4.工业上可用W的氢化物与Y的氢化物反应制得耐高温化合物和氢气,此反应的化学方程式为 .
| 1 | 3 |
(1)X、Z的元素名称分别是
(2)Y的氢化物分子的空间构型为
(3)由以上任意三种元素组成的化合物中,其水溶液显酸性的有(填写化学式)
(4)写出一个离子反应方程式,要求反应物与生成物的离子或分子均是由以上元素中的两种元素组成且各微粒所含的电子数相同.
(5)我国材料学家已成功制备了W元素与Y元素组成的耐高温的新型材料W3Y4.工业上可用W的氢化物与Y的氢化物反应制得耐高温化合物和氢气,此反应的化学方程式为
分析:X、Y、Z、W都是短周期的非金属元素,其原子序数依次增大.Y的氢化物分子中有三个共价键,处于ⅤA族,W原子的质子数是Y原子质子数的两倍,则Y处于第二周期,故Y为N元素;W的质子数为7×2=14,为Si元素;X原子与W原子的最外层电子数之和是Y和Z原子的质子数之和的
,令X最外层电子数为x,Z的质子数为z,则x+4=
(7+z),整理得3x+5=z,若x=1,则z=8,则X为氢元素、Z为氧元素,符合题意,若x=2,z=11,Na元素为金属性元素,不符合题意,若x=3,则z=14,Z为Si元素与W重复,不符合题意,若x=4,则z=17,Z的原子序数大于Si元素,不符合题意,故X为氢元素、Z为氧元素,据此解答.
| 1 |
| 3 |
| 1 |
| 3 |
解答:解:X、Y、Z、W都是短周期的非金属元素,其原子序数依次增大.Y的氢化物分子中有三个共价键,处于ⅤA族,W原子的质子数是Y原子质子数的两倍,则Y处于第二周期,故Y为N元素;W的质子数为7×2=14,为Si元素;X原子与W原子的最外层电子数之和是Y和Z原子的质子数之和的
,令X最外层电子数为x,Z的质子数为z,则x+4=
(7+z),整理得3x+5=z,若x=1,则z=8,则X为氢元素、Z为氧元素,符合题意,若x=2,z=11,Na元素为金属性元素,不符合题意,若x=3,则z=14,Z为Si元素与W重复,不符合题意,若x=4,则z=17,Z的原子序数大于Si元素,不符合题意,故X为氢元素、Z为氧元素,
(1)由上述分析可知,X为氢、Z为氧,W为Si元素,其原子结构示意图为 ,故答案为:氢;氧;
,故答案为:氢;氧; ;
;
(2)Y的氢化物为NH3,分子的空间构型为三角锥型,分子中正负电荷重心不重合,属于极性分子,故答案为:三角锥型;极性;
(3)由以上任意三种元素组成的化合物中,其水溶液显酸性,可以是酸或强酸弱碱盐,符合条件的有HNO3、NH4NO3等,故答案为:HNO3、NH4NO3;
(4)反应物与生成物的离子或分子均是由以上元素中的两种元素组成且各微粒所含的电子数相同,考虑为10电子微粒之间的反应,符合条件的离子方程式有:NH4++OH-
NH3↑+H2O[或NH3+H3O+═NH4++H2O或OH-+H3O+═2H2O],
故答案为:NH4++OH-
NH3↑+H2O[或NH3+H3O+═NH4++H2O或OH-+H3O+═2H2O];
(5)工业上可用SiH4与NH3反应制得耐高温化合物和氢气,此反应的化学方程式为3SiH4+4NH3
Si3N4+12H2,
故答案为:3SiH4+4NH3
Si3N4+12H2.
| 1 |
| 3 |
| 1 |
| 3 |
(1)由上述分析可知,X为氢、Z为氧,W为Si元素,其原子结构示意图为
 ,故答案为:氢;氧;
,故答案为:氢;氧; ;
;(2)Y的氢化物为NH3,分子的空间构型为三角锥型,分子中正负电荷重心不重合,属于极性分子,故答案为:三角锥型;极性;
(3)由以上任意三种元素组成的化合物中,其水溶液显酸性,可以是酸或强酸弱碱盐,符合条件的有HNO3、NH4NO3等,故答案为:HNO3、NH4NO3;
(4)反应物与生成物的离子或分子均是由以上元素中的两种元素组成且各微粒所含的电子数相同,考虑为10电子微粒之间的反应,符合条件的离子方程式有:NH4++OH-
| ||
故答案为:NH4++OH-
| ||
(5)工业上可用SiH4与NH3反应制得耐高温化合物和氢气,此反应的化学方程式为3SiH4+4NH3
| ||
故答案为:3SiH4+4NH3
| ||
点评:本题考查结构性质位置关系的应用,关键是X、Z元素的确定,(4)注意掌握常见10电子微粒,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

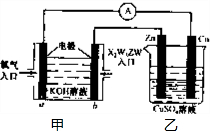 已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)
已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)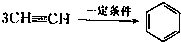 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式: