题目内容
【题目】煤炭燃烧时产生大量SO2、NO对环境影响极大。
(1)使用清洁能源可有效减少SO2等的排放。煤的液化是现代能源工业中重点推广的能源综合利用方案,最常见的液化方法为用煤生产CH3OH。已知制备甲醇的有关化学反应及平衡常数如下:
i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-a kJ/mol
CH3OH(g)+H2O(g) ΔH1=-a kJ/mol
ii:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH2=+b kJ/mol
CO(g)+H2O(g) ΔH2=+b kJ/mol
iii:CO(g)+2H2(g) ![]() CH3OH(g) ΔH3
CH3OH(g) ΔH3
ΔH3=________。
(2)在密闭容器中进行反应i,改变温度时,该反应中的所有物质都为气态,起始温度、体积相同(T1 ℃、2 L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ恒 温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应Ⅱ绝 热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡后,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)________K(Ⅱ)(填“>”“<”或“=”下同);平衡时CO2的浓度c(Ⅰ)________c(Ⅱ)。
②对反应Ⅰ,在其他条件不变下,若30 min时只改变温度为T2 ℃,再次平衡时H2的物质的量为2.5 mol,则T1________T2(填“>”“<”或“=”)。
③若30 min时只向容器中再充入1 mol H2(g)和1 mol H2O(g),则平衡________移动(填“正向”“逆向”或“不”)。
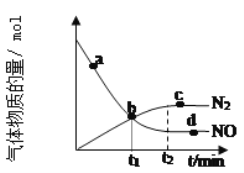
(3)研究人员发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO发生该反应,如图为容器内的压强(p)与起始压强(p0)的比值(p/p0)随时间的变化曲线。
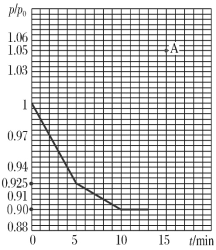
①0~5 min内,该反应的平均反应速率v(NO)=________;平衡时N2的产率为________。
②若13 min时,向该容器中再充入0.06 mol CO2,15 min时再次达到平衡,此时容器内![]() /
/![]() 的比值应在图中A点的________(填“上方”或“下方”)。
的比值应在图中A点的________(填“上方”或“下方”)。
【答案】-(a+b)kJ/mol < > > 正向 6×10-3 mol/(L·min 80% 上方
【解析】
(1)已知:i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-a kJ/mol
CH3OH(g)+H2O(g) ΔH1=-a kJ/mol
ii:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH2=+b kJ/mol
CO(g)+H2O(g) ΔH2=+b kJ/mol
iii:CO(g)+2H2(g) ![]() CH3OH(g) ΔH3
CH3OH(g) ΔH3
根据盖斯定律可知i-ii即得到CO(g)+2H2(g)![]() CH3OH(g)ΔH3=-(a+b)kJ/mol。
CH3OH(g)ΔH3=-(a+b)kJ/mol。
(2)①正反应放热,反应I是恒温恒容容器,反应Ⅱ绝热恒容,图表中反应Ⅱ若恒温恒容达到相同平衡状态,Ⅱ为逆向恒容绝热,温度降低,平衡正向进行,平衡常数增大,所以达到平衡后,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)<K(Ⅱ),平衡时CO2的浓度c(Ⅰ)>c(Ⅱ)。
②对反应Ⅰ,根据表中数据可知平衡时氢气的物质的量是3mol,在其他条件不变下,若30 min时只改变温度为T2 ℃,再次平衡时H2的物质的量为2.5 mol,说明平衡正向进行温度降低,则T1>T2。
③根据表中数据可知反应Ⅰ中平衡时二氧化碳、氢气、甲醇、水蒸气浓度分别是(mol/L)0.5、1.5、0.5、0.5,则该温度下平衡常数为![]() 。若30 min时只向容器中再充入1 mol H2(g)和1 mol H2O(g),浓度熵为
。若30 min时只向容器中再充入1 mol H2(g)和1 mol H2O(g),浓度熵为![]() ,则平衡正向移动。
,则平衡正向移动。
(3)①根据图像可知5min时混合气体的物质的量是0.4mol×0.925=0.37mol,物质的量减少0.03mol,根据方程式2NO(g)+2CO(g)=N2(g)+2CO2(g)可知消耗NO是0.06mol,浓度是0.03mol/L,所以0~5 min内,该反应的平均反应速率v(NO)=0.03mol/L÷5min=6×10-3 mol/(L·min);同理可计算平衡时气体的物质的量是0.4mol×0.9=0.36mol,减少0.04mol,所以生成氮气是0.04mol,理论上生成氮气是0.05mol,则平衡时N2的产率为![]() 。
。
②若13 min时,向该容器中再充入0.06 mol CO2,若平衡不移动,则![]() 。增大生成物浓度平衡逆向进行,混合气体的物质的量增大,则再次达到平衡,此时容器内
。增大生成物浓度平衡逆向进行,混合气体的物质的量增大,则再次达到平衡,此时容器内![]() /
/![]() 的比值应在图中A点的上方。
的比值应在图中A点的上方。