题目内容
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,可用ClO2为原料制取。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
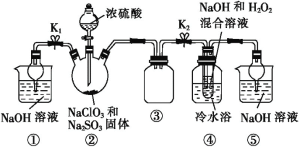
已知:饱和NaClO2溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时 NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。利用如图所示装置进行实验。
(1)装置①的作用是________,装置④中反应生成NaClO2的离子方程式为______ 。
(2)从装置④反应后的溶液中获得NaClO2晶体的操作步骤为:①_______,55 ℃蒸发结晶;②趁热过滤;③用38~60 ℃的温水洗涤;④___________________,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是______________。
(3)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4 : _______________________。
(4)为了测定NaClO2粗品的纯度,取10.0 g上述初产品溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1的Na2S2O3标准液滴定,达到注定终点时的现象为:_____________________________________________。重复3次,消耗Na2S2O3溶液的体积依次为:19.50 mL、20.50 mL、22.00 mL,则NaClO2粗品的纯度为_____。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)。
【答案】吸收多余的ClO2气体,防止污染环境 2OH-+2ClO2+H2O2=2ClO2-+2H2O+O2 减压 低于60 ℃干燥 NaClO3和NaCl 取少量晶体溶于蒸馏水,滴加几滴BaCl2溶液,若有白色沉淀出现,则含有Na2SO4,若无白色沉淀出现,则不含Na2SO4 滴入最后一滴 Na2S2O3标准液 ,溶液蓝色褪去且半分钟内颜色不再变化 90.5%
【解析】
装置②中制备得到ClO2,所以三颈瓶中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,二氧化氯和氢氧化钠反应生成NaClO2,②中可能发生Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,产生的SO2被带入④中,SO2与H2O2反应生成硫酸钠。由题目信息可知,应控制温度38℃~60℃,温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl;装置③的作用是安全瓶,有防倒吸作用,从装置④的溶液获得NaClO2晶体,需要蒸发结晶、趁热过滤、洗涤、干燥,装置①⑤是吸收多余气体防止污染,据此解答。
(1)本实验产生污染性气体,直接排放会污染环境,故需要尾气处理,装置①就是用碱吸收反应产生的ClO2等尾气,当关闭K2打开K1时,可以吸收反应产生的ClO2气体,防止污染环境;装置④中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:![]() ;
;
(2)高于60℃时![]() 分解成NaClO3和NaCl,所以在减压条件下于
分解成NaClO3和NaCl,所以在减压条件下于![]() 蒸发结晶,以防NaClO2分解;
蒸发结晶,以防NaClO2分解;![]() 时析出晶体是
时析出晶体是![]() ,为防止析出晶体
,为防止析出晶体![]() ,应趁热过滤,所以应控制温度38℃60℃进行洗涤,则从装置④反应后的溶液中获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③用38~60 ℃的温水洗涤;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,温度升高,
,应趁热过滤,所以应控制温度38℃60℃进行洗涤,则从装置④反应后的溶液中获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③用38~60 ℃的温水洗涤;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,温度升高,![]() 分解成NaClO3和NaCl,可能导致产品中混有的杂质是NaClO3和NaCl;
分解成NaClO3和NaCl,可能导致产品中混有的杂质是NaClO3和NaCl;
(3)检验所得NaClO2晶体是否含有杂质Na2SO4,可以通过检验硫酸根实现,即取少量晶体溶于蒸馏水,滴加几滴BaCl2溶液,若有白色沉淀出现,则含有Na2SO4,若无白色沉淀出现,则不含Na2SO4;
(4)碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴![]() 标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;重复3次,消耗Na2S2O3溶液的体积依次为:19.50 mL、20.50 mL、22.00 mL(误差大,舍去),平均值为20.00mL,根据关系式NaClO2~2I2~4NaS2O3可知NaClO2的纯度为
标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;重复3次,消耗Na2S2O3溶液的体积依次为:19.50 mL、20.50 mL、22.00 mL(误差大,舍去),平均值为20.00mL,根据关系式NaClO2~2I2~4NaS2O3可知NaClO2的纯度为![]() 。
。

 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】煤炭燃烧时产生大量SO2、NO对环境影响极大。
(1)使用清洁能源可有效减少SO2等的排放。煤的液化是现代能源工业中重点推广的能源综合利用方案,最常见的液化方法为用煤生产CH3OH。已知制备甲醇的有关化学反应及平衡常数如下:
i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-a kJ/mol
CH3OH(g)+H2O(g) ΔH1=-a kJ/mol
ii:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH2=+b kJ/mol
CO(g)+H2O(g) ΔH2=+b kJ/mol
iii:CO(g)+2H2(g) ![]() CH3OH(g) ΔH3
CH3OH(g) ΔH3
ΔH3=________。
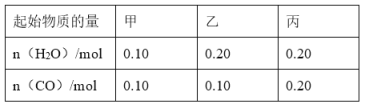
(2)在密闭容器中进行反应i,改变温度时,该反应中的所有物质都为气态,起始温度、体积相同(T1 ℃、2 L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ恒 温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应Ⅱ绝 热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡后,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)________K(Ⅱ)(填“>”“<”或“=”下同);平衡时CO2的浓度c(Ⅰ)________c(Ⅱ)。
②对反应Ⅰ,在其他条件不变下,若30 min时只改变温度为T2 ℃,再次平衡时H2的物质的量为2.5 mol,则T1________T2(填“>”“<”或“=”)。
③若30 min时只向容器中再充入1 mol H2(g)和1 mol H2O(g),则平衡________移动(填“正向”“逆向”或“不”)。
(3)研究人员发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO发生该反应,如图为容器内的压强(p)与起始压强(p0)的比值(p/p0)随时间的变化曲线。
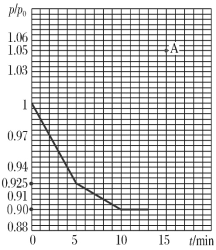
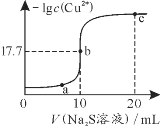
①0~5 min内,该反应的平均反应速率v(NO)=________;平衡时N2的产率为________。
②若13 min时,向该容器中再充入0.06 mol CO2,15 min时再次达到平衡,此时容器内![]() /
/![]() 的比值应在图中A点的________(填“上方”或“下方”)。
的比值应在图中A点的________(填“上方”或“下方”)。