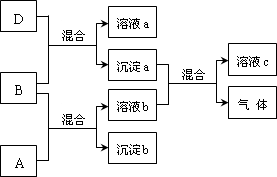
题目内容
8.下列说法符合工业实际的是( )| A. | 电解精炼铜时,粗铜板作阴极 | |
| B. | 冶金工业中,常用铝热反应原理冶炼钒、铬、锰等金属 | |
| C. | 工业上采取把氯气通入烧碱溶液的方法生产漂白粉 | |
| D. | 玻璃、水泥、高温结构陶瓷均为传统硅酸盐工业产品 |
分析 A.电解精炼粗铜时,粗铜作阳极、纯铜作阴极;
B.金属性弱于铝且熔点较高的金属可用铝热反应进行冶炼;
C.工业上制取漂白粉的化学方程式为2C12+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
D.高温结构陶瓷是新型硅酸盐工业产品.
解答 解:A.电解精炼粗铜时,粗铜作阳极、纯铜作阴极,电解过程中粗铜失电子生成铜离子进入溶液,阴极上铜离子得电子生成Cu,故A错误;
B.金属性弱于铝且熔点较高的金属可用铝热反应进行冶炼,钒、铬、锰熔点高解金属性小于Al,所以可以采用铝热反应冶炼,故B正确;
C.工业上制取漂白粉的化学方程式为2C12+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,所以工业上采取把氯气通入氢氧化钙溶液的方法生产漂白粉,故C错误;
D.高温结构陶瓷是新型硅酸盐工业产品,玻璃、陶瓷和水泥是传统硅酸盐产品,故D错误;
故选B.
点评 本题考查电解精炼、铝热反应、漂白粉的制取等知识点,侧重考查反应原理,明确物质的性质是解本题关键,注意漂白粉和漂粉精的区别,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.利用化学反应:Fe+CuSO4═FeSO4+Cu,可以设计出一种原电池.该原电池工作时( )
| A. | Fe 为正极 | B. | Cu 为负极 | ||
| C. | 负极上发生氧化反应 | D. | 正极上发生氧化反应 |
16.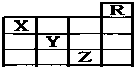 如图所示是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是:( )
如图所示是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是:( )
①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐
②同浓度X、Y、Z的气态氢化物水溶液的pH:X>Y>Z
③Z的单质在常温下是液体,可与铁粉反应
④Z的原子序数比Y大19.
 如图所示是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是:( )
如图所示是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述正确的是:( )①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐
②同浓度X、Y、Z的气态氢化物水溶液的pH:X>Y>Z
③Z的单质在常温下是液体,可与铁粉反应
④Z的原子序数比Y大19.
| A. | ③ | B. | ①②③④ | C. | ①④ | D. | ①② |
3.一定条件下,在某容积固定的密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g),下列说法中,可以说明反应达到化学平衡状态的是( )
| A. | SO2、O2、SO3共存 | |
| B. | SO2、O2、SO3的总质量保持不变 | |
| C. | SO2、O2、SO3的物质的量浓度不再发生变化 | |
| D. | 以SO2表示的正反应和逆反应速率相等,且等于零 |
13.下列各组指定的元素,不能形成AB2型化合物的是( )
| A. | 2s22p2 和2s22p4 | B. | 3s23p4 和2s22p4 | C. | 3s2和2s22p5 | D. | 3s1和3s23p5 |
20. 在盛有少量无水乙醇的试管中,加入一小块新切的、擦干表面煤油的金属钠,迅速用配有导管的单孔塞塞住试管口,用一小试管收集并验纯气体后,点燃,并把干燥的小烧杯罩在火焰上,片刻,迅速倒转烧杯,向烧杯中加入少量澄清石灰水.观察现象,完成下表.
在盛有少量无水乙醇的试管中,加入一小块新切的、擦干表面煤油的金属钠,迅速用配有导管的单孔塞塞住试管口,用一小试管收集并验纯气体后,点燃,并把干燥的小烧杯罩在火焰上,片刻,迅速倒转烧杯,向烧杯中加入少量澄清石灰水.观察现象,完成下表.
 在盛有少量无水乙醇的试管中,加入一小块新切的、擦干表面煤油的金属钠,迅速用配有导管的单孔塞塞住试管口,用一小试管收集并验纯气体后,点燃,并把干燥的小烧杯罩在火焰上,片刻,迅速倒转烧杯,向烧杯中加入少量澄清石灰水.观察现象,完成下表.
在盛有少量无水乙醇的试管中,加入一小块新切的、擦干表面煤油的金属钠,迅速用配有导管的单孔塞塞住试管口,用一小试管收集并验纯气体后,点燃,并把干燥的小烧杯罩在火焰上,片刻,迅速倒转烧杯,向烧杯中加入少量澄清石灰水.观察现象,完成下表.| 乙醇与钠反应的现象 | 气体燃烧的现象 | 结论 |
| ①Na沉到试管底部 ②反应有气泡产生 | 气体燃烧时火焰呈蓝色, 小烧杯内壁有水珠, 澄清石灰水不变浑浊. | 气体产物为H2 |
18.如图所示装置的气密性检查中,一定漏气的是( )
| A. | 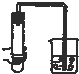 | B. |  | C. |  | D. | 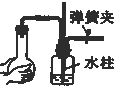 |
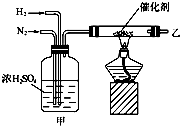 实验室合成氨的装置如图所示.
实验室合成氨的装置如图所示.