题目内容
17.现有四瓶贴有A、B、C、D标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):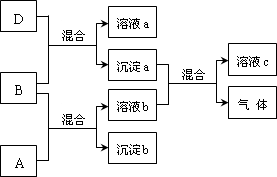
据此完成下列回答:
(1)写出各物质的化学式
A、NaHSO4 B、Ba(NO3)2 C、K2SO4
D、K2CO3
(2)写出下列反应的离子方程式:
A+B反应:Ba2++SO42-=BaSO4↓
沉淀a+溶液b:BaCO3+2H+=Ba2++CO2↑+H2O
(3)检验物质D中阴离子的方法为向D中加入足量的稀盐酸,将产生的无色无味的气体通入澄清的石灰水中,可以看到石灰水变浑浊,即证明D中含有CO32-(说明实验操作、现象与结论等).
分析 A、B、C、D的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液,根据题中各物质转化关系,生成的沉淀a和b只能是BaCO3和BaSO4,所以B中应含有Ba2+,由于沉淀a能和溶液b反应且生成气体,则沉淀a是BaCO3,溶液b中含有H+,据此可以确定B为Ba(NO3)2,D为K2CO3,A为NaHSO4,则C为K2SO4,据此可以书写离子方程式.可以利用盐酸和澄清的石灰水检验CO32-的存在.
解答 解:A、B、C、D的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液,根据题中各物质转化关系,生成的沉淀a和b只能是BaCO3和BaSO4,所以B中应含有Ba2+,由于沉淀a能和溶液b反应且生成气体,则沉淀a是BaCO3,溶液b中含有H+,据此可以确定B为Ba(NO3)2,D为K2CO3,A为NaHSO4,则C为K2SO4,
(1)根据上面的分析可知,A为NaHSO4,B为Ba(NO3)2,C为K2SO4,D为K2CO3,
故答案为:NaHSO4、Ba(NO3)2、K2SO4、K2CO3;
(2)A+B反应的离子方程式为:Ba2++SO42-=BaSO4↓,沉淀a+溶液b的离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:Ba2++SO42-=BaSO4↓;BaCO3+2H+=Ba2++CO2↑+H2O;
(3)D为K2CO3,检验物质D中阴离子的方法为向D中加入足量的稀盐酸,将产生的无色无味的气体通入澄清的石灰水中,可以看到石灰水变浑浊,即证明D中含有CO32-,
故答案为:向D中加入足量的稀盐酸,将产生的无色无味的气体通入澄清的石灰水中,可以看到石灰水变浑浊,即证明D中含有CO32-.
点评 本题考查溶液中物质之间的反应,注意根据反应的现象进行物质推断,再根据相关物质的性质解答,题目难度中等.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | 己烯、苯、苯酚 | B. | 四氯化碳、硝基苯、乙醇 | ||
| C. | 乙酸、乙醇、苯酚 | D. | 乙烷、乙烯、乙炔 |
| A. | 电解精炼铜时,粗铜板作阴极 | |
| B. | 冶金工业中,常用铝热反应原理冶炼钒、铬、锰等金属 | |
| C. | 工业上采取把氯气通入烧碱溶液的方法生产漂白粉 | |
| D. | 玻璃、水泥、高温结构陶瓷均为传统硅酸盐工业产品 |
| A. | 原子半径:A>B>C>D | B. | 原子序数:d>c>b>a | ||
| C. | 单质的还原性:A>B>D>C | D. | 离子半径:C>D>B>A |
| A. | 氯丁烷 | B. | 甲苯 | C. | 硝基苯 | D. | 乙酸 |

| A. | 1mol迷失香酸最多能和含6molNaOH的水溶液完全反应 | |
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成,和6mol溴发生取代反应 | |
| C. | 迷迭香酸属于芳香烃 | |
| D. | 迷迭香酸可以发生水解、消去、取代和酯化反应 |