��Ŀ����
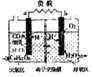
����Ŀ�������ӵĹ�ҵ��ˮ����������ͼ��ͼ��ʾ��
��1������������豸���н��е�����������������ƣ���ʵ��������һ���������������У����������ƣ���
��2�����豸������豸�������A�� �� ���豸������豸��������B��
��3�����豸���з�����Ӧ�Ļ�ѧ����ʽΪ
��4�����豸���У�����B��ˮ��Һ��CaO��Ӧ������NaOH��H2O�� �� ͨ����������������ƣ���ʹ��������룮
��5��ͼ�У���ѭ��ʹ�õ�������C6H6��CaO�� ��
���𰸡�
��1����ȡ����Һ����Һ©��
��2��C6H5ONa��NaHCO3
��3��C6H5ONa+CO2+H2O��C6H5OH+NaHCO3
��4��CaCO3������
��5��CO2��NaOH
���������⣺��1����ҵ��ˮ�뱽�����豸��õ����ӡ�������Һ������ŷŵ��ӹ�ҵ��ˮ��˵�����豸���н��е�����ȡ�����ñ��뱽�����ƵĽṹ������ˮ���ܣ������Ӵӹ�ҵ��ˮ����ȡ�������÷�Һ�ķ������²�Ĺ�ҵ��ˮ�ų��ŷţ��ϲ�ı��ӡ������Һ�����豸����ȡ����Һ�����õ����������ƽз�Һ©�����ʴ�Ϊ����ȡ����Һ����Һ©������2��ʢ�б��ӡ�����Һ���豸����ע������������Һ����ʱ���������Եı��Ӹ��������Ʒ�����Ӧ�����ɱ����ƺ�ˮ�����豸������豸�������A��C6H5ONa�����豸���е�Һ���Ϊ���㣬�ϲ��DZ��㣬�²��DZ����Ƶ�ˮ��Һ���ϲ�ı�ͨ���ܵ��ͻ��豸���м�����ȡ��ҵ��ˮ�еı��ӣ�ѭ��ʹ�ã��²�ı�������Һ�����豸������ʢ�б�������Һ���豸���У�ͨ������Ķ�����̼����������ѧ��Ӧ�����ɱ��Ӻ�̼�����ƣ��ʴ�Ϊ��C6H5ONa��NaHCO3����3������̼���Աȱ��ӵ�����ǿ���������롰ǿ���ᷢ���ĸ��ֽⷴӦ��������̼�ͱ����Ʒ�Ӧ���ɱ��ӣ���Ӧ�ķ���ʽΪC6H5ONa+CO2+H2O��C6H5OH+NaHCO3 �� �ʴ�Ϊ��C6H5ONa+CO2+H2O��C6H5OH+NaHCO3����4��ʢ��̼��������Һ���豸���У�������ʯ�ң���ʯ����̼��������Һ���ˮ��Ӧ�����������ƣ���ʯ�Һ���̼�����Ʒ������ֽⷴӦ�����ɳ�������Һ�����ͨ�����˷��룬�ʴ�Ϊ��CaCO3�����ˣ���5���豸��Ӧ��ʯ��Ҥ��CaCO3���·ֽ����õIJ�Ʒ�������ƺͶ�����̼�����ö�����̼ͨ���豸��Ӧ���������ƽ����豸�����ں����ӹ�ҵ��ˮ��ȡ���ӵĹ��������У����������ơ�CO2����NaOH������Ӧ��û�����ģ����Ǿ�����ѭ��ʹ�ã��ʴ�Ϊ��CO2��NaOH��
��1������ȡ���ӣ��������������������Һ�����Ӻ��������Ʒ�Ӧ�����÷�Һ���ݴ˼��ɽ�𣻣�2����Һ�ϲ�Ϊ�����²�Ϊ�����ƣ���3����������Һͨ�����������̼�����ɱ��Ӻ�̼�����ƣ���4������BΪ̼��������Һ����5��������������ͼ�е����ʣ��ҳ���Ӧ���������Ȼ������������е����ʱ�������Ӧ��ļ�Ϊ��ѭ�����õ����ʣ�

 �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д� С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�