题目内容
(1)配平可逆反应:
已知400℃时,1.6 mol NO和NH3混合气体发生以上反应达到平衡后,混合气体的物质的量变为1.7 mol,则被氧化的N的物质的量为 。
(2)已知某温度下0.01 mol/L盐酸溶液中水电离的c(H+)="l" x 10-11mol/L,则Kw= ;若在此温度下将pH==a的NaOH溶液与pH=b的盐酸按1:100体积刚好完全反应,a、b应满足关系为 。
(3)有一种白色固体,可能含有CaCO3、Ba(N O3)2、NH4 C1、KCl、A gN O3、Al2(SO4)3
和KMnO4中的一种或几种。①将白色固体用水溶解并过滤,②将滤渣加入足量盐酸中,滤渣全部溶解并放出气体;③向滤液中加入足量浓NaOH溶液,加热,放出能使湿润红色石蕊试纸变蓝的气体,待溶液冷却后,继续滴入适量的稀盐酸,有白色沉淀产生。则该白色固体中一定有 ,可能有 。

已知400℃时,1.6 mol NO和NH3混合气体发生以上反应达到平衡后,混合气体的物质的量变为1.7 mol,则被氧化的N的物质的量为 。
(2)已知某温度下0.01 mol/L盐酸溶液中水电离的c(H+)="l" x 10-11mol/L,则Kw= ;若在此温度下将pH==a的NaOH溶液与pH=b的盐酸按1:100体积刚好完全反应,a、b应满足关系为 。
(3)有一种白色固体,可能含有CaCO3、Ba(N O3)2、NH4 C1、KCl、A gN O3、Al2(SO4)3
和KMnO4中的一种或几种。①将白色固体用水溶解并过滤,②将滤渣加入足量盐酸中,滤渣全部溶解并放出气体;③向滤液中加入足量浓NaOH溶液,加热,放出能使湿润红色石蕊试纸变蓝的气体,待溶液冷却后,继续滴入适量的稀盐酸,有白色沉淀产生。则该白色固体中一定有 ,可能有 。

本题考查氧化还原反应的配平及计算、有关溶液pH计算和物质的检验。
(1)该反应是氧化还原反应,可用得失电子法配平,6NO+4NH3
 5N2+6H2O,按化学平衡方程式计算:6NO+4NH3
5N2+6H2O,按化学平衡方程式计算:6NO+4NH3 5N2+6H2O △n
5N2+6H2O △n6 4 1
x y 1.7 mol-1.6 mol= 0.1mol
解得:x="0.6" mol y="0.4" mol,NH3被氧化,则被氧化的N的物质的量为0.4 mol。
(2)在水溶液中,水电离H2O
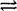 H++OH-,故c(H+)水=c(OH-)水=lx10-11mol/L,c(OH-)aq=c(OH-)水=lx10-11mol/L,c(H+)aq=" c(HCl)=" 0.01 mol/L,Kw= c(H+)aq×c(OH-)aq= 0.01×lx10-11=" l" x10-13;pH=a的NaOH溶液中c(OH-)=lx10-13/10-a=10 a -13mol/L,pH=b的盐酸中c(H+)=10 -bmol/L,据H++OH-=H2O,则10 -bmol/L×100=10 a -13mol/L×1,得a+b=11。
H++OH-,故c(H+)水=c(OH-)水=lx10-11mol/L,c(OH-)aq=c(OH-)水=lx10-11mol/L,c(H+)aq=" c(HCl)=" 0.01 mol/L,Kw= c(H+)aq×c(OH-)aq= 0.01×lx10-11=" l" x10-13;pH=a的NaOH溶液中c(OH-)=lx10-13/10-a=10 a -13mol/L,pH=b的盐酸中c(H+)=10 -bmol/L,据H++OH-=H2O,则10 -bmol/L×100=10 a -13mol/L×1,得a+b=11。(3) 由①可知没有KMnO4(紫色)存在,由②可知有CaCO3存在,由③可知有NH4 C1、Al2(SO4)3存在,由于NH4 C1、Al2(SO4)3存在,则Ba(N O3)2、A gN O3不能存在(会与前者产生沉淀,不溶解于足量盐酸)。故一定有CaCO3、NH4 C1、Al2(SO4)3存在,可能有KCl。

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目