题目内容
如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡常数表达式为: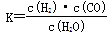 ,它所对应反应的化学方程式是
,它所对应反应的化学方程式是
_________________________________。
(2)合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
①该时间段内反应速率v(H2)=
②比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向 (填“逆向”、“正向”或“不”)移动,平衡常数K (填“增大”、“减小” 或“不变”)。
(3)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:N2 (g) + O2 (g) →2NO (g) -180.8 kJ,工业合成氨则是人工固氮。分析两种固氮反应的平衡常数,下列结论正确的是 。
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
A.常温下,大气固氮很难进行,而工业固氮却能非常容易进行
B.模拟大气固氮应用于工业上的意义不大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(1)C+H2O (g)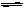 CO + H2 (2分)
CO + H2 (2分)
(2)①0.08mol/(L·min) ② > ③ 正向 ,不变 (各1分,共4分)
(3)BC (2分)
解析试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据平衡表达式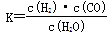 可知,生成物为CO、H2,反应物含有H2O,三者化学计量数分别为1、1、1,根据原子守恒可知,另一反应物为固体C,因此该反应的化学方程式为C(s)+H2O(g)
可知,生成物为CO、H2,反应物含有H2O,三者化学计量数分别为1、1、1,根据原子守恒可知,另一反应物为固体C,因此该反应的化学方程式为C(s)+H2O(g) CO(g)+H2(g)。
CO(g)+H2(g)。
(2)①由表中数据可知,l0min内甲醇的浓度变化为0.4mol/L,所以用甲醇表示的反应速率v(CH3OH)=0.4mol/L÷10min=0.04mol/(L?min)。又因为速率之比等于化学计量数之比,故v(H2)=2v(CH3OH)=2×0.04mol/(L?min)=0.08mol/(L?min)。
②10min时,CO的浓度为0.1mol/L,氢气的浓度为0.2mol/L,甲醇的浓度为0.4mol/L,故此时的浓度商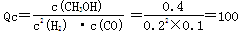 ,小于平衡常数160,故反应向正反应进行,即v正>v逆。
,小于平衡常数160,故反应向正反应进行,即v正>v逆。
③容器的体积缩小一半,压强增大,平衡向体积减小的方向移动,故平衡向正反应移动;平衡常数只受温度影响,与压强无关,温度不变,平衡常数不变。
(3)A、化学平衡常数说明可逆反应正向进行的程度,与反应进行的难易程度无关,故A错误;B、大气固氮的进行程度很小,利用大气固氮原理进行工业生成,产率很小,没有实际意义,故B正确;C、合成氨是放热反应,温度越低,有利于平衡向正反应移动,反应的转化率越高,反应越完全,故C正确;D、化学平衡常数说明可逆反应正向进行的程度,与反应速率无关,故D错误
考点:考查可逆反应速率、平衡常数的计算与应用以及外界条件对反应速率和平衡状态的影响等

 步步高达标卷系列答案
步步高达标卷系列答案在温度为298K时,将0.10 mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g) 2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。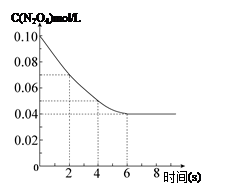
|
(3)在温度为298K时,达到平衡时四氧化二氮的转化率α1等于 。化学平衡常数为 。
(4)若在7s时向该密闭容器中再充入0.10 mol N2O4气体,此时平衡向 方向移动(填“正”或“逆”);再次达平衡时,总计0.20 mol N2O4的转化率为α2,正确的是 ( )
A.α2<α1 B.α2>α1 C.α2=α1 D.无法判断。
(5)下表是不同温度下测定的该反应的化学平衡常数。
| T/K | 310 | 320 |
| K值 | 0.38 | 0.42 |
据此判断该反应正反应是 反应(填“吸热”或“放热”)
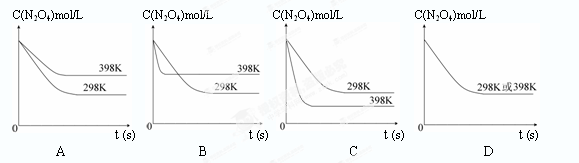
(6)若其他条件不变,反应在398K条件下进行并达到平衡,此温度下N2O4的浓度随时间变化的曲线(以298K条件下进行并达到平衡的曲线作为参照)正确的是 ( )
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式 。
②由上表数据可知该反应为放热反应,理由是 。
③理论上,为了增大平衡时H2的转化率,可采取的措施是 。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)
 CO(g)+3H2(g) 获取,已知该反应中,当初始混合气
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: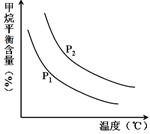
①图中,两条曲线表示压强的关系是:P1 P2(填“>”、“=”或“<”)。
②该反应为 反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g)+H2O(g)
 CO2 (g)+H2(g) 获取。
CO2 (g)+H2(g) 获取。①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度
为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说
明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2)=1 : 16 : 6 : 6
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):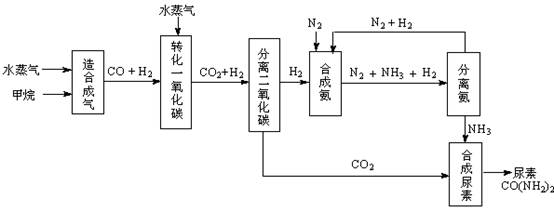
(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g) 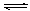 CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g) +CO(g) 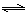 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
提高氢碳比[ n(H2O)/n(CO)],K值 (填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1∶3,此时v(正) v(逆)(填“>”、“=”或“<”)。
(3)有关合成氨工业的说法中正确的是 。
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3)∶n(CO2)的最佳配比为 ,而实际生产过程中,往往使n(NH3)∶n(CO2)≥3,这是因为 。
(5)当甲烷合成氨气的转化率为60%时,以3.0×108 L甲烷为原料能够合成 L 氨气。(假设体积均在标准状况下测定)
一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)  Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
| 反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
| c(X)/(mol·L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
(1)3min时用Z表示的平均反应速率v(Z)= 。
(2)分析该反应中反应物的浓度与时间的规律,得出的结论是 。由此规律推出反应在6min时反应物的浓度a为 mol·L-1。
(3)反应的逆反应速率随时间变化的关系如图,t2时改变了某一种条件,改变的条件可能是 、 (填写两顶)
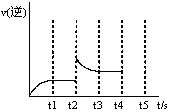
(4)下列哪些情况表明容器中已达平衡状态 (填字母序号)
A.容器体积一定时气体密度不再变化
B.反应的平衡常数不再变化
C.容器中气体的平均相对分子质量不随时间而变化
D.Y的物质的量不再发生变化
E.Z的生成速率等于X的消耗速率的2倍
(16分)高铁酸钠(Na2FeO4)具有很强的氧化性,广泛应用于净水、电池工业等领域。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下,回答下列问题: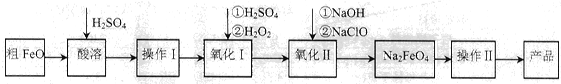
已知:NaClO不稳定,受热易分解。
(1)粗FeO酸溶过程中通入水蒸气(高温),其目的是__________________________。
(2)操作I目的是得到高纯度FeSO4溶液,则氧化I中反应的离子方程式为_________。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备
①Cl2与NaOH溶液反应的离子方程式为_________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/℃ | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
其原因为____________________________________________________________________。
(4)工业也常用电解法制备Na2FeO4,其原理为Fe+2OH-+2H2O电解FeO42-+3H2↑。请用下列材料设计电解池并在答题卡的方框内画出该装置。

可选材料:铁片、铜片、碳棒、浓NaOH溶液、浓HCl等
其阳极反应式为:________________________________。

 Si (s)+ 4HCl(g) -236kJ
Si (s)+ 4HCl(g) -236kJ 放出气泡很慢,加入少量MnO
放出气泡很慢,加入少量MnO 很快产生气体:________;
很快产生气体:________;