��Ŀ����
���¶�Ϊ298Kʱ����0.10 mol��ɫ��N2O4�������1L��յ��ܱ������У����ֺ���ɫ��ֱ������N2O4(g) 2NO2(g)��ƽ�⡣��ͼ��ʾ�ⶨN2O4��Ũ����ʱ���ϵ�����ߣ�������ΪN2O4��Ũ�ȣ�������Ϊʱ�䣩��
2NO2(g)��ƽ�⡣��ͼ��ʾ�ⶨN2O4��Ũ����ʱ���ϵ�����ߣ�������ΪN2O4��Ũ�ȣ�������Ϊʱ�䣩��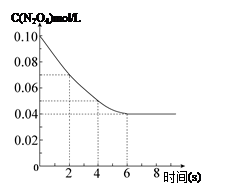
|
��3�����¶�Ϊ298Kʱ���ﵽƽ��ʱ������������ת���ʦ�1���� ����ѧƽ�ⳣ��Ϊ ��
��4������7sʱ����ܱ��������ٳ���0.10 mol N2O4���壬��ʱƽ���� �����ƶ�����������桱�����ٴδ�ƽ��ʱ���ܼ�0.20 mol N2O4��ת����Ϊ��2����ȷ���� ( )
A����2<��1 B����2>��1 C����2=��1 D�����жϡ�
��5���±��Dz�ͬ�¶��²ⶨ�ĸ÷�Ӧ�Ļ�ѧƽ�ⳣ����
| T/K | 310 | 320 |
| Kֵ | 0.38 | 0.42 |
�ݴ��жϸ÷�Ӧ����Ӧ�� ��Ӧ������ȡ����ȡ���
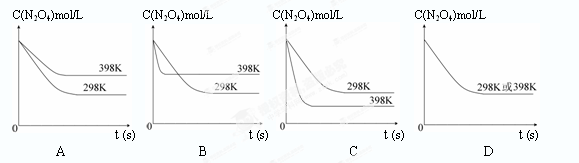
��6���������������䣬��Ӧ��398K�����½��в��ﵽƽ�⣬���¶���N2O4��Ũ����ʱ��仯�����ߣ���298K�����½��в��ﵽƽ���������Ϊ���գ���ȷ���� ( )

���������������1����ͼ���֪2s��4sʱ����N2O4��Ũ�ȱ仯Ϊ0.02 mol/L������v=��c/��t��Ϸ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȼ���ɵã�ע��д�嵥λ��
��2������һ�������µĿ��淴Ӧ�����۷�Ӧ������ʼ���Ǵ�����ʼ��ֻҪ�����������ʵ����൱���ͻ�ﵽͬһƽ��״̬����ͼ���֪c(N2O4)�ij�ʼŨ��Ϊ0.10mol/L��Ҫ�ﵽͬ����ƽ��״̬��������������ʼŨ����0.20mol��L-1
��3������N2O4����ʼŨ�Ⱥ�ת��Ũ�����ת���ʣ�����N2O4��NO2��ƽ��Ũ�Ⱥ�ƽ�ⳣ������ʽ��ƽ�ⳣ����
��4������һ�������µĿ��淴ӦN2O4(g) 2NO2(g)��ƽ����ٳ���0.10 mol N2O4���壬�����˷�Ӧ��Ũ��ƽ���������ƶ����ټ���N2O4��ƽ��״̬�൱������ѹǿ��ƽ�����ƣ�N2O4��ת���ʼ�С��
2NO2(g)��ƽ����ٳ���0.10 mol N2O4���壬�����˷�Ӧ��Ũ��ƽ���������ƶ����ټ���N2O4��ƽ��״̬�൱������ѹǿ��ƽ�����ƣ�N2O4��ת���ʼ�С��
��5���ɱ������ݿ�֪���¶����ߣ�ƽ�ⳣ��������˵�������¶ȣ�ƽ��������Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ��
��6�����淴ӦN2O4(g) 2NO2(g) ����ӦΪ���ȷ�Ӧ������ƽ���������ƶ���N2O4��ƽ��Ũ�ȼ�С�����·�Ӧ���ʼӿ죬�����̴�ƽ���ʱ�䣬���ͼ��ѡC��
2NO2(g) ����ӦΪ���ȷ�Ӧ������ƽ���������ƶ���N2O4��ƽ��Ũ�ȼ�С�����·�Ӧ���ʼӿ죬�����̴�ƽ���ʱ�䣬���ͼ��ѡC��
���㣺�����˻�ѧ��Ӧ���ʵļ��㡢��ѧƽ�������ʽ����Ӧ�á�Ӱ�����صķ����жϷ�������ƽ�ⳣ���ļ���Ӧ�ü����ͼ��

����̿�ɴ���������Ⱦ��NO��T��ʱ����1L�ܱ������м���NO�����̿�ۣ�������Ӧ������������A��B����ø����ʵ����ʵ������£�
| | ����̿/mol | NO/mol | A/mol | B/mol |
| ��ʼ״̬ | 2.030 | 0.100 | 0 | 0 |
| 2 minʱ | 2.000 | 0.040 | 0.030 | 0.030 |
��1��2 min�ڣ���NO��ʾ�÷�Ӧ��ƽ������v(NO)��______mol��L-1��min-1��
��2���÷�Ӧ�Ļ�ѧ����ʽ��______��T��ʱ������ƽ�ⳣ��K��9/16����2 minʱ��Ӧ______����ǡ����ǡ���ƽ��״̬����֪�����¶�ʱ��K������÷�ӦΪ______������ȡ����ȡ�����Ӧ��
��3��Ϊ����߷�Ӧ���ʺ�NO��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��______��
��һ��������ܱ������У��������»�ѧ��Ӧ��
Fe2O3(s)��3CO(g)  2Fe(s)��3CO2(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2Fe(s)��3CO2(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t�� | 1000 | 1150 | 1300 |
| K | 64.0 | 50.7 | 42.9 |
��ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK�� ��
��2���÷�ӦΪ ��Ӧ������ȡ����ȡ�����
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬�������� ����ѡ��,��ѡ���÷֣���
a��������ѹǿ���� b����������� c��CO������
c��������CO����������CO2�� d��c��CO2����c��CO��
��4����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����10min��ﵽƽ�⡣���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ����
��(CO)�� ��CO��ƽ��ת����Ϊ�� ��
��ҵ������CO��ˮ������һ�������·�����Ӧ��ȡ������CO(g)+H2O(g) CO2(g)+H2(g)ij�о�С��ֱ��������Ϊ2L�ĺ����ܱ������м���һ�����ķ�Ӧ�ʹ�䷢����Ӧ������������£�
CO2(g)+H2(g)ij�о�С��ֱ��������Ϊ2L�ĺ����ܱ������м���һ�����ķ�Ӧ�ʹ�䷢����Ӧ������������£�
| ������� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ���ʱ��/min | �ﵽƽ��ʱ��ϵ�����ı仯/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| �� | 650 | 1 | 2 | 0��4 | 0��4 | 5 | 16��4 |
| �� | 650 | 2 | 4 | | | t1 | Q1 |
| �� | 900 | 2 | 4 | 1��6 | 1��6 | t2 | Q2 |
(2)�������з�Ӧ��ƽ��ʱ��CO��ת����Ϊ____________��
(3)�������з�Ӧ��ƽ�����ʱ�䣬��ѧ��Ӧ����
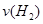 =__________��
=__________��(4)�÷�Ӧ������ӦΪ_______������ȡ����ȡ�����Ӧ��������____________��
(5)����������ȷ����____________������ĸ��ţ���
a��ƽ��ʱ�������ٺ���������CO2������������
b����Ӧ��ƽ��״̬ʱ��Q2��Q1��32��8kJ
c���ﵽƽ���ʱ�䣺t2��t1��2��5min
d���÷�Ӧ���Ȼ�ѧ����ʽ�ɱ�ʾΪ��CO(g)+H2O(g)
 CO2(g)+H2(g) ��H= -41kJ/mol
CO2(g)+H2(g) ��H= -41kJ/mol ��ͼ��ú������ҵ����һ���֣���������ѧ֪ʶ������������⣺
��1����֪�ò�ҵ����ij��Ӧ��ƽ�ⳣ������ʽΪ��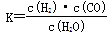 ��������Ӧ��Ӧ�Ļ�ѧ����ʽ��
��������Ӧ��Ӧ�Ļ�ѧ����ʽ��
_________________________________��
��2���ϳɼ״�����Ҫ��Ӧ�ǣ�2H2��g��+CO��g�� CH3OH��g��+90.8kJ��t���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧl0min���ø���ֵ�Ũ�����£�
CH3OH��g��+90.8kJ��t���´˷�Ӧ��ƽ�ⳣ��Ϊ160�����¶��£����ܱ������п�ʼֻ����CO��H2����Ӧl0min���ø���ֵ�Ũ�����£�
| ���� | H2 | CO | CH3OH |
| Ũ�ȣ�mol/L�� | 0.2 | 0.1 | 0.4 |
�ٸ�ʱ����ڷ�Ӧ����v(H2)=
�ڱȽϴ�ʱ�����淴Ӧ���ʵĴ�С��v�� v�����>������<����=����
�۷�Ӧ�ﵽƽ����������������䣬��ֻ�������������Сһ�룬ƽ���� (�������������)�ƶ���ƽ�ⳣ��K (���������С�� ���䡱)��
��3���̵��ǿ�ѧ�������о�����Ҫ���⡣��Ȼ���д�����Ȼ�Ĵ����̵����̣�N2 (g) + O2 (g) ��2NO (g) ��180.8 kJ����ҵ�ϳɰ������˹��̵����������̵ֹ���Ӧ��ƽ�ⳣ�������н�����ȷ���� ��
| ��Ӧ | �����̵� | ��ҵ�̵� | ||||
| �¶�/�� | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84��10-31 | 0.1 | 5��108 | 1.847 | 0.507 | 0.152 |
A�������£������̵����ѽ��У�����ҵ�̵�ȴ�ܷdz�������
B��ģ������̵�Ӧ���ڹ�ҵ�ϵ����岻��
C����ҵ�̵�ʱ�¶�Խ�ͣ�������������ӦԽ��ȫ
D��KԽ��˵���ϳɰ���Ӧ������Խ��
 CH3OH ( g ) ��H=-116kJ/mol
CH3OH ( g ) ��H=-116kJ/mol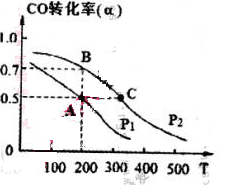
 C(g)
C(g) 
 xC��g�� ��H ��:
xC��g�� ��H ��:
 C(g)��ƽ��ʱC ���������Ϊ40�G��
C(g)��ƽ��ʱC ���������Ϊ40�G��