题目内容
(16分)高铁酸钠(Na2FeO4)具有很强的氧化性,广泛应用于净水、电池工业等领域。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下,回答下列问题: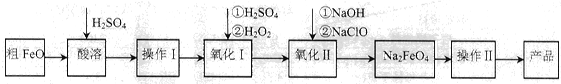
已知:NaClO不稳定,受热易分解。
(1)粗FeO酸溶过程中通入水蒸气(高温),其目的是__________________________。
(2)操作I目的是得到高纯度FeSO4溶液,则氧化I中反应的离子方程式为_________。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备
①Cl2与NaOH溶液反应的离子方程式为_________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/℃ | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
其原因为____________________________________________________________________。
(4)工业也常用电解法制备Na2FeO4,其原理为Fe+2OH-+2H2O电解FeO42-+3H2↑。请用下列材料设计电解池并在答题卡的方框内画出该装置。

可选材料:铁片、铜片、碳棒、浓NaOH溶液、浓HCl等
其阳极反应式为:________________________________。
(1)升高温度加快反应速率 或 增大接触面积加快反应速率 或 提高酸溶效率(2分)
(2)2Fe2++H2O2+2H+=2Fe3++2H2O(3分) (3)①Cl2+2OH-=Cl-+ClO-+H2O(2分)
②温度小于30℃时,NaClO浓度随温度升高而增大;温度高于30℃时,NaClO浓度随温度升高而降低。(2分)温度小于30℃时,升高温度,反应速率增大;温度高于30℃时,NaClO不稳定而分解。(2分)
(4)如右图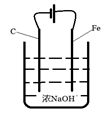 :(阴极材料可为Cu或Fe)(3分)
:(阴极材料可为Cu或Fe)(3分)
Fe - 6e-+ 8OH- =FeO42-+ 4H2O(2分)
解析试题分析:(1)高温水蒸气可以作答固体与酸反应的接触面积,同时升高温度反应速率也加快,因此粗FeO酸溶过程中通入水蒸气(高温),其目的是升高温度加快反应速率或增大接触面积加快反应速率或提高酸溶效率。
(2)操作I目的是得到高纯度FeSO4溶液,由于双氧水具有氧化性,能把亚铁离子氧化生成铁离子,则氧化I中反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)①Cl2与NaOH溶液反应制备次氯酸钠的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
②根据表中数据可知温度小于30℃时,NaClO浓度随温度升高而增大;温度高于30℃时,NaClO浓度随温度升高而降低。这是由于温度小于30℃时,升高温度,反应速率增大;而温度高于30℃时,NaClO不稳定而分解导致浓度降低。
(4)根据Fe+2OH-+2H2O电解FeO42-+3H2↑可知,铁失去电子被氧化,因此铁是阳极与电源的正极相连,而电解质溶液是碱性溶液,所以装置图可以是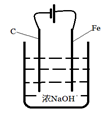 ,其中阳极反应式为Fe - 6e-+ 8OH- =FeO42-+ 4H2O。
,其中阳极反应式为Fe - 6e-+ 8OH- =FeO42-+ 4H2O。
考点:考查外界条件对反应速率的影响、离子方程式书写以及电化学原理的应用

如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡常数表达式为: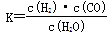 ,它所对应反应的化学方程式是
,它所对应反应的化学方程式是
_________________________________。
(2)合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
①该时间段内反应速率v(H2)=
②比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向 (填“逆向”、“正向”或“不”)移动,平衡常数K (填“增大”、“减小” 或“不变”)。
(3)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:N2 (g) + O2 (g) →2NO (g) -180.8 kJ,工业合成氨则是人工固氮。分析两种固氮反应的平衡常数,下列结论正确的是 。
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
A.常温下,大气固氮很难进行,而工业固氮却能非常容易进行
B.模拟大气固氮应用于工业上的意义不大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
|
|
|
|

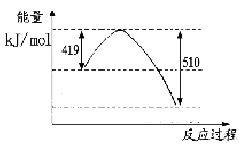 写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。该反应的△S____0(填“>”或“<”或“=”),在 ______情况下有利于该反应自发进行。
(2)如果上述反应方程式的平衡常数K值变大,则该反应__ (选填编号)。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是 __ (选填编号)。
A.3v正(H2)=v逆(CO2) B.C(H2) = C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
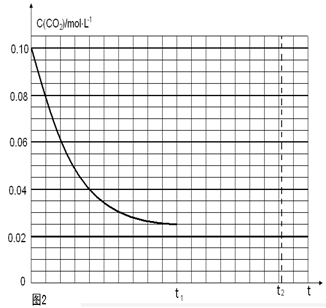
(4)若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度增大了2.0g/L,在这段时间内CO2的平均反应速率为 。反应在t1时达到平衡,过程中c(CO2)随时间t变化趋势曲线右图所示。保持其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
(19分)钒有金属“维生素”之称,研究发现钒的某些化合物对治疗糖尿病有很好的疗效。
工业上设计将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤②、③的变化过程可表示为(HM为有机萃取剂):
VOSO4 (水层)+ 2HM(有机层) VOM2(有机层) + H2SO4 (水层)
VOM2(有机层) + H2SO4 (水层)
步骤②中萃取时必须加入适量碱,其原因是 。
步骤③中X试剂为 。
(2)步骤④的离子方程式为
(3)该工艺流程中,可以循环利用的物质有 和 。
(4)操作Ⅰ得到的废渣,用 溶解,充分反应后, ,(填写系列操作名称)称量得到mg氧化铜。
(5)为了制得氨水,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为① |
| 乙小组 | ② | 浓氨水、氢氧化钠固体 | 分析产生氨气的原因③ |
 CO2(g)+H2(g)
CO2(g)+H2(g)

 N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。


 的化学平衡常
的化学平衡常 。
。
 2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。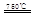 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg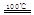 HgBr2+H2
HgBr2+H2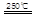 _____ + ④2HgO
_____ + ④2HgO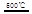 2Hg+O2↑
2Hg+O2↑ CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0