ЬтФПФкШн
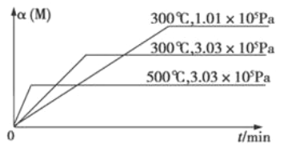
ЁОЬтФПЁПtЁцЪБЃЌНЋ3molAКЭ1molBЦјЬхЭЈШыШнЛ§ЮЊ2LЕФУмБеШнЦїжаЃЈШнЛ§ВЛБфЃЉЃЌЗЂЩњШчЯТЗДгІ3A(g)+B(g) ![]() xC(g)ЃЌ2minЪБЗДгІЕНДяЦНКтзДЬЌЃЈЮТЖШВЛБфЃЉЃЌДЫЪБШнЦїФкЪЃгрСЫ0.8molBЃЌВЂВтЕУCЕФХЈЖШЮЊ0.4molЁЄLЃ1ЁЃЧыЬюаДЯТСаПеАзЃК
xC(g)ЃЌ2minЪБЗДгІЕНДяЦНКтзДЬЌЃЈЮТЖШВЛБфЃЉЃЌДЫЪБШнЦїФкЪЃгрСЫ0.8molBЃЌВЂВтЕУCЕФХЈЖШЮЊ0.4molЁЄLЃ1ЁЃЧыЬюаДЯТСаПеАзЃК
ЃЈ1ЃЉДгЗДгІПЊЪМЕНЦНКтзДЬЌЃЌЩњГЩCЕФЦНОљЗДгІЫйТЪЮЊ ЁЃ
ЃЈ2ЃЉx= ЁЃ
ЃЈ3ЃЉШєЯђдЦНКтЛьКЯЮяЕФШнЦїжадйГфШыamolCЃЌдкtЁцЪБДяЕНаТЕФЦНКтЃЌДЫЪБBЕФЮяжЪЕФСПЮЊn(B)= molЁЃ
ЃЈ4ЃЉБЃГжЮТЖШКЭЬхЛ§ВЛБфЃЌЖддЦНКтЛьКЯЮяжаШ§епЕФЮяжЪЕФСПзїШчЯТЕїећЃЌПЩЪЙЦНКтЯђгввЦЖЏЕФЪЧ ЃЈЬюзжФИЃЉЁЃ
AЃЎОљМѕАы BЃЎОљМгБЖ CЃЎОљдіМг0.4mol DЃЎОљМѕаЁ0.4mol
ЃЈ5ЃЉШчЙћЩЯЪіЗДгІдкЯрЭЌЮТЖШКЭШнЛ§ЕФШнЦїжаНјааЃЌЦ№ЪММгШы3molAКЭ3molBЃЌДяЕНЦНКтЪБAЕФЬхЛ§ЗжЪ§ЮЊa%ЁЃЦфЫќЬѕМўВЛБфЪБЃЌАДЯТСаХфБШзїЮЊЦ№ЪМЮяжЪЃЌЦНКтЪБAЕФЬхЛ§ЗжЪ§Дѓгкa%ЕФЪЧ ЃЈЬюзжФИЃЉЁЃ
AЃЎ2molC BЃЎ1molAЁЂ3molBКЭ4molC
CЃЎ1molBКЭ4molC DЃЎ6molAКЭ2molB
ЁОД№АИЁП
ЃЈ1ЃЉ0.2 molЁЄLЃ1ЁЄminЃ1ЃЛ
ЃЈ2ЃЉ4ЃЛ
ЃЈ3ЃЉ0.8+0.2aЃЛ
ЃЈ4ЃЉDЃЛ
ЃЈ5ЃЉAЁЂCЁЂD
ЁОНтЮіЁП
ЪдЬтЗжЮіЃКЃЈ1ЃЉЩњГЩCЕФЦНОљЗДгІЫйТЪv=![]() =
=![]() =0.2mol/ЃЈLЃЎminЃЉЃЌЙЪД№АИЮЊЃК0.2mol/ЃЈLЃЎminЃЉЃЛ
=0.2mol/ЃЈLЃЎminЃЉЃЌЙЪД№АИЮЊЃК0.2mol/ЃЈLЃЎminЃЉЃЛ
ЃЈ2ЃЉВЮМгЗДгІЕФBЕФЮяжЪЕФСП=ЃЈ1-0.8ЃЉmol=0.2molЃЌдђBЕФЗДгІЫйТЪ=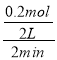 =0.05mol/LЃЌCЕФЦНОљЗДгІЫйТЪЮЊ0.2mol/ЃЈLЃЎminЃЉЃЌЭЌвЛПЩФцЗДгІЁЂЭЌвЛЪБМфЖЮФкИїЮяжЪЕФЗДгІЫйТЪжЎБШЕШгкЦфМЦСПЪ§жЎБШЃЌBЁЂCЕФМЦСПЪ§жЎБШЕШгкЦфЗДгІЫйТЪжЎБШ=0.05mol/ЃЈLЃЎminЃЉЃК0.2mol/ЃЈLЃЎminЃЉ=1ЃК4ЃЌЫљвдx=4ЃЌЙЪД№АИЮЊЃК4ЃЛ
=0.05mol/LЃЌCЕФЦНОљЗДгІЫйТЪЮЊ0.2mol/ЃЈLЃЎminЃЉЃЌЭЌвЛПЩФцЗДгІЁЂЭЌвЛЪБМфЖЮФкИїЮяжЪЕФЗДгІЫйТЪжЎБШЕШгкЦфМЦСПЪ§жЎБШЃЌBЁЂCЕФМЦСПЪ§жЎБШЕШгкЦфЗДгІЫйТЪжЎБШ=0.05mol/ЃЈLЃЎminЃЉЃК0.2mol/ЃЈLЃЎminЃЉ=1ЃК4ЃЌЫљвдx=4ЃЌЙЪД№АИЮЊЃК4ЃЛ
ЃЈ3ЃЉЕквЛДЮЦНКтЪБAЕФЮяжЪЕФСПХЈЖШ=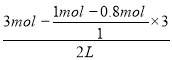 =1.2mol/LЁЂBЕФЮяжЪЕФСПХЈЖШ=
=1.2mol/LЁЂBЕФЮяжЪЕФСПХЈЖШ=![]() =0.4mol/LЁЂCЕФЮяжЪЕФСПХЈЖШ=0.4mol/LЃЌЛЏбЇЦНКтГЃЪ§K=
=0.4mol/LЁЂCЕФЮяжЪЕФСПХЈЖШ=0.4mol/LЃЌЛЏбЇЦНКтГЃЪ§K=![]() =
=![]() ЃЌ
ЃЌ
ЩшЦНКтЪБBЕФЮяжЪЕФСПЮЊyЃЌ
3AЃЈgЃЉ + BЃЈgЃЉ ![]() 4CЃЈgЃЉ
4CЃЈgЃЉ
ПЊЪМ 1.2 0.4 0.4
ЗДгІ 3ЃЈ0.4-![]() ЃЉ ЃЈ0.4-
ЃЉ ЃЈ0.4-![]() ЃЉ 4ЃЈ0.4-
ЃЉ 4ЃЈ0.4-![]() ЃЉ
ЃЉ
ЦНКт[1.2-3ЃЈ0.4-![]() ЃЉ]
ЃЉ] ![]() [0.4-4ЃЈ0.4-
[0.4-4ЃЈ0.4-![]() ЃЉ+
ЃЉ+![]() ]ЃЌ
]ЃЌ
ЮТЖШВЛБфЃЌЛЏбЇЦНКтГЃЪ§ВЛБфЃЌЛЏбЇЦНКтГЃЪ§K= =
=![]() ЃЌy=1.2-
ЃЌy=1.2-![]() ЃЌЙЪД№АИЮЊЃК1.2-
ЃЌЙЪД№АИЮЊЃК1.2-![]() ЃЛ
ЃЛ
ЃЈ4ЃЉШчЙћХЈЖШЩЬДѓгкЦНКтГЃЪ§ЃЌдђЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌAЃЎОљМѕАыЪБЃЌЦфХЈЖШОљЪЧдРДЕФвЛАыЃЌдђХЈЖШЩЬ=![]() K=KЃЌЫљвдЦНКтВЛвЦЖЏЃЌЙЪДэЮѓЃЛBЃЎОљМгБЖЪБЃЌЦфХЈЖШОљЪЧдРДЕФЖўБЖЃЌдђХЈЖШЩЬ=
K=KЃЌЫљвдЦНКтВЛвЦЖЏЃЌЙЪДэЮѓЃЛBЃЎОљМгБЖЪБЃЌЦфХЈЖШОљЪЧдРДЕФЖўБЖЃЌдђХЈЖШЩЬ=![]() K=KЃЌЫљвдЦНКтВЛвЦЖЏЃЌЙЪДэЮѓЃЛCЃЎОљдіМг0.4molЃЌЦфХЈЖШЩЬ=
K=KЃЌЫљвдЦНКтВЛвЦЖЏЃЌЙЪДэЮѓЃЛCЃЎОљдіМг0.4molЃЌЦфХЈЖШЩЬ=![]() =ЃЈ
=ЃЈ![]() ЃЉ3ЃОЃЈ
ЃЉ3ЃОЃЈ![]() ЃЉ3ЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌЙЪДэЮѓЃЛDЃЎОљМѕЩй0.4molЃЌЦфХЈЖШЩЬ=
ЃЉ3ЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌЙЪДэЮѓЃЛDЃЎОљМѕЩй0.4molЃЌЦфХЈЖШЩЬ=![]() =ЃЈ
=ЃЈ![]() ЃЉ3ЃМЃЈ
ЃЉ3ЃМЃЈ![]() ЃЉ3ЃЌдђЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌЙЪе§ШЗЃЛЙЪбЁDЃЛ
ЃЉ3ЃЌдђЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌЙЪе§ШЗЃЛЙЪбЁDЃЛ
ЃЈ5ЃЉЗДгІ3AЃЈgЃЉ+BЃЈgЃЉ![]() 4CЃЈgЃЉжаЃЌЦјЬхЬхЛ§дкЗДгІЧАКѓЯрЭЌЃЌдквЛЖЈЮТЖШЯТЃЌдкКуШнУмБеШнЦїжаЕУЕНЦНКтзДЬЌЃЌжЛвЊТњзуЮяжЪШЋВПзЊЛЏЮЊAЁЂBЃЌЧвТњзуnЃЈAЃЉЃКnЃЈBЃЉ=1ЃК1ЃЌМДПЩЕУЕНЯрЭЌЦНКтзДЬЌЃЌШєвЊЦНКтКѓAЕФЬхЛ§ЗжЪ§Дѓгкa%ЃЌЫЕУїЦНКтЯђзѓвЦЖЏЃЌИљОнЕШаЇЦНКтЃЌАбЮяжЪЖМЛЛЫуГЩЗНГЬЪНвЛБпЕФЮяжЪЃЌТњзуnЃЈAЃЉЃКnЃЈBЃЉЃО1ЃК1МДПЩЁЃAЃЎ2molCЭъШЋзЊЛЏЮЊ1.5molAЁЂ0.5molBЃЌЖўепЮяжЪЕФСПжЎБШЮЊ3ЃК1ЃО1ЃК1ЃЌЙЪAе§ШЗЃЛ BЃЎ1molAЁЂ3molBКЭ4molCЭъШЋзЊЛЏЮЊAЁЂBЪБЃЌAЕФЮяжЪЕФСПЮЊ4molAЁЂ4molBЃЌЖўепЕФЮяжЪЕФСПжЎБШЕШгк1ЃК1ЃЌЕШаЇЦНКтЃЌдђAЕФЬхЛ§ЗжЪ§ЮЊa%ЃЌЙЪBДэЮѓЃЛCЃЎ1mol BКЭ4molCЃЌCЭъШЋзЊЛЏЮЊAЁЂBЪБЃЌAЕФЮяжЪЕФСПЪЧ3molЁЂBЕФЮяжЪЕФСПЮЊ2molЃЌAЁЂBЕФЮяжЪЕФСПжЎБШ1.5ЃО1ЃЌЙЪCе§ШЗЃЛDЃЎ6molAКЭ2molBЃЌЖўепЕФЮяжЪЕФСПжЎБШЮЊ3ЃК1ЃО1ЃЌЫљвдЦНКтЪБAЕФЬхЛ§ЗжЪ§Дѓгкa%ЃЌЙЪDе§ШЗЃЛЙЪбЁACDЁЃ
4CЃЈgЃЉжаЃЌЦјЬхЬхЛ§дкЗДгІЧАКѓЯрЭЌЃЌдквЛЖЈЮТЖШЯТЃЌдкКуШнУмБеШнЦїжаЕУЕНЦНКтзДЬЌЃЌжЛвЊТњзуЮяжЪШЋВПзЊЛЏЮЊAЁЂBЃЌЧвТњзуnЃЈAЃЉЃКnЃЈBЃЉ=1ЃК1ЃЌМДПЩЕУЕНЯрЭЌЦНКтзДЬЌЃЌШєвЊЦНКтКѓAЕФЬхЛ§ЗжЪ§Дѓгкa%ЃЌЫЕУїЦНКтЯђзѓвЦЖЏЃЌИљОнЕШаЇЦНКтЃЌАбЮяжЪЖМЛЛЫуГЩЗНГЬЪНвЛБпЕФЮяжЪЃЌТњзуnЃЈAЃЉЃКnЃЈBЃЉЃО1ЃК1МДПЩЁЃAЃЎ2molCЭъШЋзЊЛЏЮЊ1.5molAЁЂ0.5molBЃЌЖўепЮяжЪЕФСПжЎБШЮЊ3ЃК1ЃО1ЃК1ЃЌЙЪAе§ШЗЃЛ BЃЎ1molAЁЂ3molBКЭ4molCЭъШЋзЊЛЏЮЊAЁЂBЪБЃЌAЕФЮяжЪЕФСПЮЊ4molAЁЂ4molBЃЌЖўепЕФЮяжЪЕФСПжЎБШЕШгк1ЃК1ЃЌЕШаЇЦНКтЃЌдђAЕФЬхЛ§ЗжЪ§ЮЊa%ЃЌЙЪBДэЮѓЃЛCЃЎ1mol BКЭ4molCЃЌCЭъШЋзЊЛЏЮЊAЁЂBЪБЃЌAЕФЮяжЪЕФСПЪЧ3molЁЂBЕФЮяжЪЕФСПЮЊ2molЃЌAЁЂBЕФЮяжЪЕФСПжЎБШ1.5ЃО1ЃЌЙЪCе§ШЗЃЛDЃЎ6molAКЭ2molBЃЌЖўепЕФЮяжЪЕФСПжЎБШЮЊ3ЃК1ЃО1ЃЌЫљвдЦНКтЪБAЕФЬхЛ§ЗжЪ§Дѓгкa%ЃЌЙЪDе§ШЗЃЛЙЪбЁACDЁЃ

ЁОЬтФПЁПдкNa+ХЈЖШЮЊ0.5molLЉ1ЕФФГГЮЧхШмвКжаЃЌЛЙПЩФмКЌгаЯТБэжаЕФШєИЩжжРызгЃЎ
ЃЈвбжЊH2SiO3ЮЊВЛШмгкЫЎЕФНКзДГСЕэЃЌМгШШЪБвзЗжНтЮЊСНжжбѕЛЏЮяЃЉ
бєРызг | K+ | Ag+ | Ca2+ | Ba2+ |
вѕРызг | NO3Љ | CO32Љ | SiO32Љ | SO42Љ |
ЯжШЁИУШмвК100mLНјааШчЯТЪЕбщЃЈЦјЬхЬхЛ§ОљдкБъзМзДПіЯТВтЖЈЃЉЃЎ
ађКХK] | ЪЕбщФкШн | ЪЕбщНсЙћ |
Ђё | ЯђИУШмвКжаМгШызуСПЯЁбЮЫс | ВњЩњАзЩЋНКзДГСЕэВЂЗХГіБъзМзДПіЯТ0.56LЦјЬх |
Ђђ | НЋЂёЕФЗДгІЛьКЯвКЙ§ТЫЃЌЖдГСЕэЯДЕгЁЂзЦЩежСКужиЃЌГЦСПЫљЕУЙЬЬхжЪСП | ЙЬЬхжЪСПЮЊ2.4g |
Ђѓ | ЯђЂђЕФТЫвКжаЕЮМгBaCl2ШмвК | ЮоУїЯдЯжЯѓ |
ЧыЛиД№ЯТСаЮЪЬтЃЎ
ЃЈ1ЃЉЪЕбщЂёФмШЗЖЈвЛЖЈВЛДцдкЕФРызгЪЧЃЛ
ЃЈ2ЃЉЪЕбщЂёжаЩњГЩЦјЬхЕФРызгЗНГЬЪНЮЊЃЛ
ЃЈ3ЃЉЭЈЙ§ЪЕбщЂёЁЂЂђЁЂЂѓКЭБивЊМЦЫуЃЌЬюаДЯТБэжавѕРызгЕФХЈЖШЃЈФмМЦЫуГіЕФЃЌЬюаДМЦЫуНсЙћЃЌвЛЖЈВЛДцдкЕФРызгЬюЁА0ЁБЃЌВЛФмШЗЖЈЪЧЗёДцдкЕФРызгЬюЁАЃПЁБЃЉЃЎ
вѕРызг | NO3Љ | CO32Љ | SiO32Љ | SO42Љ |
c/molLЉ1 |