题目内容
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如图:

回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是 .
(2)步骤②反应的离子方程式是 .
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为 .
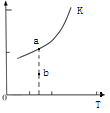
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线Ⅰ比曲线Ⅱ对应的污水pH (填“高”或“低”).

(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的 (填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是 (答出两点即可).
【答案】(1)高铁酸钠(Na2FeO4)只能在碱性溶液中稳定存在,加入氢氧化钠固体可以调节溶液呈碱性。(2分)
(2)2Fe2++H2O2+2H+═2Fe3++2H2O(2分) (3)2Fe3++3ClO﹣+10OH﹣═2FeO42﹣+3Cl﹣+5H2O(2分)
(4)高(1分)(5)低(1分) 既能消毒杀菌又能净水(或无毒或方便保存等)(答出两点即可)
【解析】
试题分析:(1)步骤①是制备次氯酸钠的过程,加入氢氧化钠的目的是调节溶液显碱性,因为高铁酸钠(Na2FeO4)只能在碱性溶液中稳定存在,加入氢氧化钠固体可以调节溶液呈碱性。
(2)步骤②是加入过氧化氢在酸性溶液中氧化亚铁离子为铁离子的过程,反应的离子方程式为2Fe2+ +H2O2+2H+═2Fe3++2H2O。
(3)反应③是碱溶液中次氯酸根离子氧化铁离子为高铁酸根离子,反应的离子方程式为:2Fe3++3ClO﹣+10OH﹣═2FeO42﹣+3Cl﹣+5H2O。
(4)依据高铁酸钠在碱性溶液中稳定存在,发生的反应为:FeO42-+3e-+4H2OFe(OH)3+5OH-,污水的PH越高平衡逆向进行,PH越小平衡正向进行,依据图象分析Ⅱ先达到平衡需要的时间短,反应速率快,说明污水PH小,曲线I比曲线II对应的污水的PH高。
(5)FeO42-+3e-+4H2OFe(OH)3+5OH-,单位质量得到电子3÷166==0.018,Cl2+2e-=2Cl-,单位质量得到电子2÷71=0.028,所以Na2FeO4的消毒效率比氯气低,高铁酸钠代替氯气作净水消毒剂,利用氧化性起到杀菌消毒作用,利用生成的氢氧化铁胶体起到净水作用,所以既能消毒杀菌又能净水。

【题目】反应:MgSO4(s) + CO(g)![]() MgO(s)+CO2(g)+SO2(g) ΔH>0。在恒容密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g) ΔH>0。在恒容密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,y随x变化趋势合理的是
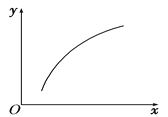
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |