题目内容
1.下列说法正确的是( )| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | C(石墨)=C(金刚石)△H>0,则石墨比金刚石稳定 | |
| C. | H2(g)+F2(g)=2HF(g);△H1=-270kJ/mol,则1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270热量 | |
| D. | S(s)+O2(g)=SO2(g);△H1,S(g)+O2(g)=SO2(g);△H2,△H1>△H2 |
分析 A、有些反应需加热,却是放热反应;
B、根据能量越低越稳定;
C、△H=-270kJ/mol 表示1mol氢气与1mol氟气完全反应生成2mol气态氟化氢放出的热量为270kJ;
D、S(s)变成气体需要吸热.
解答 解:A、有些反应需加热,却是放热反应,如红磷燃烧,要先点燃,但是放热的,故A错误;
B、能量越低越稳定,又C(石墨)=C(金刚石)△H>0,所以C(石墨)小于C(金刚石)能量,则石墨比金刚石稳定,故B正确;
C、H2(g)+F2(g)=2HF(g);△H1=-270kJ/mol,则表示1mol氢气与1mol氟气完全反应生成2mol气态氟化氢放出的热量为270kJ,故C错误;
D、S(s)变成气体需要吸热,所以S(s)+O2(g)=SO2(g);△H1,S(g)+O2(g)=SO2(g);△H2,故△H1>△H2,故D正确;
故选:BD.
点评 该题考查了化学反应的条件与化学反应的热效应间的关系.需正确理解放热吸热的本质,是解题的关键.

练习册系列答案
相关题目
1.下列酸性氧化物和碱反应时,反应速率最慢的是( )
| A. | 二氧化碳气体通入氨水中 | B. | 二氧化硫气体通入澄清石灰水中 | ||
| C. | 五氧化二磷投入碱溶液中 | D. | 二氧化硅投入烧碱溶液中 |
12.SO2和NO2是主要的大气污染物,不能直接排放到大气中.下列措施不能有效防止大气污染的是( )
| A. | 将机动车尾气排放标准从国家Ⅱ号标准提高到国家Ⅲ号标准 | |
| B. | 采用强氧化剂将SO2氧化为SO3再排放到大气中 | |
| C. | 采用原煤脱硫技术,降低燃煤中硫的含量 | |
| D. | 向燃煤中加入适量石灰石,减少燃烧产物中SO2的量 |
9.如图是某燃煤发电厂处理废气的装置示意图,下列说法不正确的是( )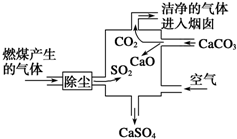

| A. | 进入烟囱的气体为混合物 | |
| B. | 此过程中硫元素的化合价没有发生改变 | |
| C. | 使用此废气处理装置可减少酸雨的形成 | |
| D. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 |
16.已知X、Y是短周期的两种元素,下列有关比较或说法中一定正确的是( )
| 选项 | 条件 | 结论 |
| A | 若X原子半径X>Y | 原子序数:X<Y |
| B | 若最高价氧化物对应水化物酸性X>Y | 元素的电负性:X>Y |
| C | 若价电子数X>Y | 最高正价:X>Y |
| D | 若X、Y最外层电子数分别为1、7 | X、Y之间一定能形成离子键 |
| A. | A | B. | B | C. | C | D. | D |
6.减少酸雨产生的合理措施( )
①把工厂烟囱造高 ②燃料脱硫 ③开发洁净能源 ④在酸化土壤中加入石灰⑤用煤作燃料.
①把工厂烟囱造高 ②燃料脱硫 ③开发洁净能源 ④在酸化土壤中加入石灰⑤用煤作燃料.
| A. | ①②⑤ | B. | ①②③④ | C. | ②③ | D. | ②④⑤ |
13.将盛有a mL NO2和O2的试管倒扣在水里,最后试管中剩余气体的体积是$\frac{a}{6}$mL.则原试管中NO2和O2的体积比是( )
| A. | 6:1 | B. | 2:1 | C. | 1:2 | D. | 9:1 |
10.下列关于Na2O2的说法正确的是( )
| A. | SO2和CO2都是酸性氧化物,SO2与Na2O2反应生成Na2SO3和O2 | |
| B. | 84 g NaHCO3受热分解,将生成的气体通过足量的Na2O2,固体质量增加31 g | |
| C. | 将Na2O2投入到酚酞试液中,溶液变红 | |
| D. | Na2O2与水的反应中,Na2O2既是氧化剂,又是还原剂 |