题目内容
从淡化海水中提取溴的流程如图所示,下列有关说法错误的是
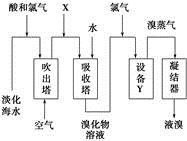

| A.X为SO2气体,也可将SO2换成Na2SO3 |
| B.设备Y为蒸馏塔 |
| C.在提取溴的过程中一定有Br-被氧化 |
| D.工业上每获得1 mol Br2,需要消耗Cl2的体积最多为44.8 L(标准状况下) |
D
选项A,Br2也能被Na2SO3溶液吸收形成Br-。选项B,Br-先被Cl2氧化为Br2,然后经蒸馏得到Br2蒸气。选项C,海水中Br-被氧化为Br2以及吸收塔内都发生了Br-被氧化的反应。选项D,根据选项C分析可知,两步反应都发生Cl2氧化Br-的反应,考虑到氯气部分溶于水等因素,实际生产中工业上每获得1 mol Br2,需要消耗Cl2的体积大于44.8 L(标准状况下)。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( ) =11,则溶液中
=11,则溶液中 =
=
 amol
amol amol
amol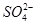 )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
 为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。 NO2
NO2 N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。 N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下: