题目内容
12.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物.进行如下实验:①取适量A进行铝热反应,产物中有单质B生成;
②另取20g A全部溶于0.15L 6.0mol•盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色.请填空:
(1)①中引发铝热反应的实验操作加少量KClO3,插上镁条并将其点燃,产物中的单质B是Fe.
(2)②中所发生的各反应的化学方程式是MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O
(3)③中所发生的各反应的离子方程式是Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+.
(4)若溶液D的体积仍视为0.15L,则该溶液中c(Mg2+)为0.67mol/L,c(Fe2+)为2.33mol/L.
分析 ①铝热反应本质是置换反应,金属性Al>Fe,所以发生Al与Fe2O3反应,置换出铁,即B为Fe;
②MgO与盐酸反应生成氯化镁与水,Fe2O3与盐酸反应生成氯化铁与水,溶液C中含有MgCl2、FeCl3;
③单质B和溶液C反应,放出1.12L(标准状况)气体,说明生成氢气,说明②中盐酸过量,溶液C为MgCl2、FeCl3、HCl混合溶液,反应同时生成溶液D,还残留有固体物质B,说明Fe有剩余,结合④用KSCN溶液检验时,溶液D不变色,说明D溶液不含铁离子,则D中溶质为MgCl2、FeCl2.
(1)①中引发铝热反应操作为:加少量KClO3,插上镁条并将其点燃;
(2)氧化镁与盐酸反应生成氯化镁与水,氧化铁与盐酸反应生成氯化铁与水;
(3)Fe与盐酸反应生成氯化亚铁与氢气,Fe与氯化铁反应生成氯化亚铁;
(4)计算MgO和Fe2O3的物质的量,溶液D为MgCl2、FeCl2的混合溶液,根据镁元素守恒可知,n(Mg2+)=n(MgO),再根据c=$\frac{n}{V}$计算镁离子浓度,根据电荷守恒溶液中2c(Mg2+)+2c(Fe2+)=c(Cl-),据此计算亚铁离子浓度.
解答 解:①铝热反应本质是置换反应,金属性Al>Fe,所以发生Al与Fe2O3反应,置换出铁,即B为Fe;
②MgO与盐酸反应生成氯化镁与水,Fe2O3与盐酸反应生成氯化铁与水,溶液C中含有MgCl2、FeCl3;
③单质B和溶液C反应,放出1.12L(标准状况)气体,说明生成氢气,说明②中盐酸过量,溶液C为MgCl2、FeCl3、HCl混合溶液,反应同时生成溶液D,还残留有固体物质B,说明Fe有剩余,结合④用KSCN溶液检验时,溶液D不变色,说明D溶液不含铁离子,则D中溶质为MgCl2、FeCl2.
(1)①中引发铝热反应操作为:加少量KClO3,插上镁条并将其点燃,产物中的单质B是Fe,
故答案为:加少量KClO3,插上镁条并将其点燃;Fe;
(2)氧化镁与盐酸反应生成氯化镁与水,氧化铁与盐酸反应生成氯化铁与水,反应方程式为:MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O,
故答案为:MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O;
(3)Fe与盐酸反应生成氯化亚铁与氢气,反应离子方程式为:Fe+2H+=Fe2++H2↑,铁与氯化铁反应生成氯化亚铁,反应离子方程式为Fe+2Fe3+=3Fe2+,
故答案为:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;
(4)令MgO和Fe2O3的物质的量分别为xmol,则40x+160x=20,解得x=0.1,溶液D为MgCl2、FeCl2的混合溶液,根据镁元素守恒可知,n(Mg2+)=n(MgO)=0.1mol,所以c(Mg2+)=$\frac{0.1mol}{0.15L}$=0.67mol/L;根据电荷守恒溶液中2c(Mg2+)+2c(Fe2+)=c(Cl-),所以2×0.67mol/L+2c(Fe2+)=6mol/L,解得c(Fe2+)=2.33mol/L,
故答案为:0.67mol/L;2.33mol/L.
点评 本题考查元常用化学用语、混合物有关计算、物质的量浓度计算等,难度中等,理解反应过程是解题的关键,注意(4)利用电荷守恒计算.

| A. | 电池内部电子从正极流向负极 | |
| B. | 负极电极反应式为:CH4-8e-+10OH-═CO32-+7H2O | |
| C. | 正极电极反应式为:O2+4e-═2O2- | |
| D. | 每消耗22.4 L CH4,外线路中将通过8 mol电子 |
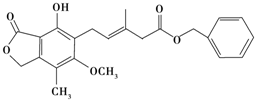
| A. | 该化合物可与NaHCO3溶液反应放出CO2气体 | |
| B. | 1 mol该化合物最多可以与3 mol NaOH反应 | |
| C. | 该化合物可以使酸性KMnO4溶液褪色 | |
| D. | 该化合物可以在光照下与Cl2发生取代反应 |
| A. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气除去乙烯 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸酸化 | |
| C. | 用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 | |
| D. | 制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤 |
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
| A. | K+一定存在 | B. | 100mL溶液中含0.01mol CO32- | ||
| C. | Ba2+一定不存在,Mg2+可能存在 | D. | Cl-一定存在 |
| A. | H | B. | Li | C. | Na | D. | K |

①水分子间既有氢键又有范德华力;
②每个水分子处在另外四个水分子所围成的四面体中;
③每个O原子处在四个H原子所围成的四面体中;
④晶胞与金刚石相似;
⑤与干冰的晶胞相似;
⑥每个水分子平均拥有四个氢键;
⑦冰的结构是由氢键的方向性和饱和性所决定的;
⑧冰中H和O原子之间的作用力不是σ键就是氢键.
| A. | 除⑤⑥外 | B. | 除④⑦⑧外 | C. | 除④⑤⑥⑧外 | D. | 全对 |
| A. | 0.1mol•L-1CH3COOH溶液中:c(CH3COO-)<c(H+) | |
| B. | 0.1mol•L-1NH4Cl溶液中:c(NH+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 浓度均为0.1mol•L-1NH4Cl、CH3COONH4、NH4HSO4溶液中,c(NH4+)的大小顺序:CH3COONH>NH4Cl>NH4HSO4 |
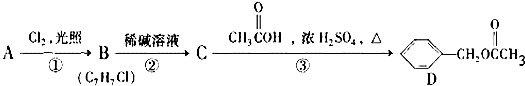
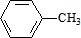 ,C的名称:苯甲醇.
,C的名称:苯甲醇.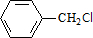 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$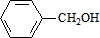 +NaCl.
+NaCl. .
.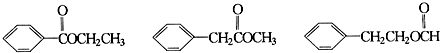 .
.