题目内容
16.(1)如图1是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下问题.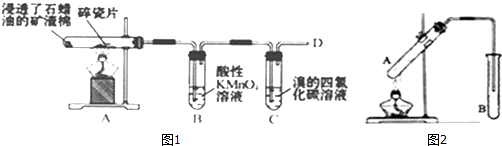
①A中碎瓷片的作用是催化作用
②B中反应类型是氧化反应;C中实验现象是溴的四氯化碳褪色
(2)制取氯乙烷(CH3CH2Cl)的最佳方法是(用化学方程式表示):CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl
(3)用空气吹溴水到SO2水溶液中的化学方程式:Br2+SO2+2H2O=H2SO4+2HBr.
(4)把干海带放在坩埚(仪器的名称)中灼烧,将灼烧后的海带溶于水,过滤,把滤液酸化,再加H2O2氧化后能使淀粉溶液变蓝,反应的离子方程式H2O2+2I-+2H+=I2+2H2O
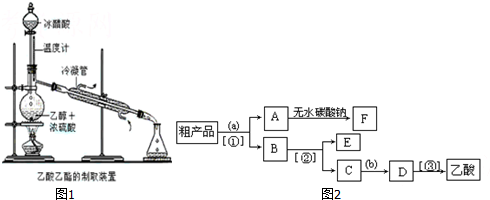
(5)在试管A中加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸.按图2所示连接好装置制取乙酸乙酯.
①试管B中盛放饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇和降低乙酸乙酯的溶解度
②实验完成后,若要分离B中的液体混合物,需用到的玻璃仪器除烧杯外还有分液漏斗.
分析 (1)①碎瓷片有催化作用;
②乙烯能被酸性高锰酸钾氧化;乙烯能和溴发生加成反应;
(2)加成反应产物只有一种,无副产物生成;
(3)二氧化硫具有还原性、溴具有氧化性,二者能发生氧化还原反应;
(4)把海带放在坩埚中灼烧;酸性条件下,双氧水将碘离子氧化碘单质;
(5)①乙酸能和饱和碳酸钠反应生成醋酸钠,乙醇易溶于水,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小;
②互不相溶的液体采用分液的方法分离.
解答 解:(1)①石蜡油在炽热碎瓷片的作用下产生乙烯,反应前后碎瓷片的质量不变,所以碎瓷片作催化剂,起催化作用,
故答案为:催化作用;
②B中乙烯使酸性KMnO4溶液褪色,是因为乙烯发生了氧化反应,把KMnO4还原而使之褪色;C中乙烯与溴的四氯化碳溶液发生加成反应,实验现象是溴的四氯化碳褪色,
故答案为:氧化反应;溴的四氯化碳褪色;
(2)加成反应产物只有一种,无副产物生成,故应选用乙烯与氯化氢制取氯乙烷,反应的方程式为:CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl,
故答案为:CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl;
(3)二氧化硫具有还原性、溴具有氧化性,二者能发生氧化还原反应生成硫酸和氢溴酸,反应方程式为:Br2+SO2+2H2O=H2SO4+2HBr,
故答案为:Br2+SO2+2H2O=H2SO4+2HBr;
(4)把固体的灼烧用到的主要仪器为坩埚,干海带应放在坩埚中灼烧,海带中含有碘元素,以碘离子形式存在,将灼烧后的海带溶于水,过滤,把滤液酸化,再加H2O2氧化后能使淀粉溶液变蓝,碘离子被H2O2氧化生成单质碘,反应的离子方程式为:H2O2+2I-+2H+=I2+2H2O,
故答案为:坩埚;H2O2+2I-+2H+=I2+2H2O;
(5)①制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:降低乙酸乙酯的溶解度;
②乙酸乙酯不溶于饱和碳酸钠溶液且密度比水小,应用分液的方法分离,要分离B中的液体混合物,需用到的玻璃仪器除烧杯外还有分液漏斗,
故答案为:分液漏斗.
点评 本题考查了石蜡油分解制乙烯及乙烯的化学性质、乙酸乙酯的制备、海带充分中碘的检验等知识,题目难度中等,试题知识点较多,充分考查学生灵活应用基础知识的能力,注意掌握乙酸乙酯的制备原理、石蜡油制乙烯的原理,能够正确书写常见反应的离子方程式、化学方程式.

| A. | H | B. | Li | C. | Na | D. | K |
| A. | 乙醇 | B. | 乙醛 | C. | 乙酸 | D. | 乙酸乙酯 |
| A. | 0.1mol•L-1CH3COOH溶液中:c(CH3COO-)<c(H+) | |
| B. | 0.1mol•L-1NH4Cl溶液中:c(NH+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 浓度均为0.1mol•L-1NH4Cl、CH3COONH4、NH4HSO4溶液中,c(NH4+)的大小顺序:CH3COONH>NH4Cl>NH4HSO4 |
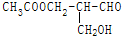 有光学活性,发生下列反应后生成的有机物无光学活性的是( )
有光学活性,发生下列反应后生成的有机物无光学活性的是( )| A. | 与甲酸发生酯化反应 | B. | 与NaOH水溶液共热 | ||
| C. | 与银氨溶液作用 | D. | 在与Br2作用 |
| A. | 盐 | B. | 氧化物 | C. | 含氧酸 | D. | 混合物 |
| A. | 纯银器表面在干燥空气中因电化学腐蚀渐渐变暗 | |
| B. | 在海轮外壳连接锌块是采用了牺牲阳极的阴极保护法 | |
| C. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |

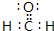 ,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为平面三角形.
,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为平面三角形.