题目内容
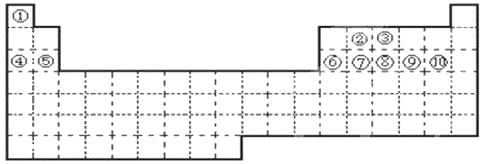
【题目】有A、B、C、D 4种短周期元素,它们的元素原子序数依次增大,由B、C、D形成的离子具有相同的电子层结构。B原子的最外层电子数是次外层的三倍,C、D单质都能跟水剧烈反应,1 mol D单质跟水反应产生11.2 L(标准状况)A气体,此时D转化为具有氖原子核外电子层结构的离子。试填写:
(1)用电子式表示A和C形成化合物的过程______________。
(2)C原子的结构示意图_______________,写出A、B两元素按1:1原子个数比形成化合物的电子式_______________。
(3)这4种元素的原子半径由大到小的顺序为_______________。(用元素符号表示)
(4)写出C单质与水反应的化学反应方程式__________________________;。
(5)写出D单质与水反应的离子方程式__________________________,
【答案】(1)![]() ;
;
(2)![]() ,
,![]() ;
;
(3) Na>O>F> H ;
(4) 2F2+2H2O=4HF+O2;
(5) 2Na+2H2O═2Na++2OH-+H2↑
【解析】试题分析:有A、B、C、D 4种短周期元素,它们的元素原子序数依次增大,由B、C、D形成的离子具有相同的电子层结构。B原子的最外层电子数是次外层的三倍,说明B只有两个电子层,最外层电子数为6,B是O元素,C、D单质都能跟水剧烈反应,C是F元素, 1 mol D单质跟水反应产生11.2 L(标准状况)A气体,此时D转化为具有氖原子核外电子层结构的离子,D是Na元素,A是H元素,(1)HF是共价化合物,形成过程为:![]() ,答案为:
,答案为:![]() ;(2)F原子的原子结构示意图为:
;(2)F原子的原子结构示意图为:![]() ,H元素和O元素按原子个数比为1:1形成的化合物是H2O2,电子式为:
,H元素和O元素按原子个数比为1:1形成的化合物是H2O2,电子式为:![]() ,答案为:
,答案为:![]() ,
,![]() ;(3)(3)电子层数越多原子半径越大,电子层数相同时核电荷越多原子半径约小,所以H、O、F、Na这4种元素的原子半径由大到小的顺序为:Na>O>F> H,答案为:Na>O>F> H;(4)F2和水反应生成HF和O2,反应的化学方程式为:2F2+2H2O=4HF+O2,答案为:2F2+2H2O=4HF+O2;(5)钠与水反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,答案为:2Na+2H2O═2Na++2OH-+H2↑。
;(3)(3)电子层数越多原子半径越大,电子层数相同时核电荷越多原子半径约小,所以H、O、F、Na这4种元素的原子半径由大到小的顺序为:Na>O>F> H,答案为:Na>O>F> H;(4)F2和水反应生成HF和O2,反应的化学方程式为:2F2+2H2O=4HF+O2,答案为:2F2+2H2O=4HF+O2;(5)钠与水反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,答案为:2Na+2H2O═2Na++2OH-+H2↑。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案