题目内容
20.对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答):| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)气态氢化物溶于水呈碱性的化合物是NH3.
(3)⑩号元素最高正价含氧酸只具有共价键.
(4)彼此间形成共价化合物数量最多的两种元素分别是C、H.
(5)含氧量最高的共价化合物是
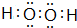 (用电子式表示).
(用电子式表示).(6)①⑤⑦形成的化合物化学式为NaOH,含有的化学键类型是离子键、共价键.
(7)某元素气态氢化物为H2B,最高价氧化物含B的质量分数为40%,则气态氢化物的化学式为H2S,它与③形成的化合物的化学式为CS2,含有的化学键有共价键.
分析 由元素在周期表中的位置,可知:①为H、②为He、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl元素.
(1)只需形成一个共价单键就能达到稳定结构,该原子最外层有7个电子或为氢元素;
(2)氨气的水溶液呈碱性;
(3)⑩号元素最高正价含氧酸为HClO4,均由非金属元素之间形成的共价键;
(4)C、H元素可以组成有机物,物质种类繁多;
(5)含氧量最高的共价化合物为H2O2;
(6)①⑤⑦形成的化合物为NaOH;
(7)某元素气态氢化物为H2B,最高价氧化物为BO3,含B的质量分数为40%,令B的相对原子质量为a,则$\frac{a}{a+48}$×100%=40%,解得a=32,故B为硫元素.
解答 解:由元素在周期表中的位置,可知:①为H、②为He、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl元素.
(1)只需形成一个共价单键就能达到稳定结构,该原子最外层有7个电子或为氢元素,即有H、F、Cl,故答案为:H、F、Cl;
(2)NH3溶于水得到一水合氨,一水合氨电离为铵根离子与氢氧根离子,水溶液呈碱性,故答案为:NH3;
(3)⑩号元素最高正价含氧酸为HClO4,均由非金属元素之间形成的共价键,只有含有共价键,故答案为:共价;
(4)C、H元素可以组成有机物,物质种类繁多,故答案为:C、H;
(5)含氧量最高的共价化合物为H2O2,其电子式为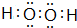 ,故答案为:
,故答案为: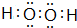 ;
;
(6)①⑤⑦形成的化合物为NaOH,含有离子键、共价键,故答案为:NaOH;离子键、共价键;
(7)某元素气态氢化物为H2B,最高价氧化物为BO3,含B的质量分数为40%,令B的相对原子质量为a,则$\frac{a}{a+48}$×100%=40%,解得a=32,故B为硫元素,则气态氢化物的化学式为H2S,它与③形成的化合物的化学式为CS2,含有的化学键为共价键,故答案为:H2S;CS2;共价键.
点评 本题考查元素周期表和元素周期律的综合应用,难度不大,熟练掌握元素周期表结构,试题培养了学生灵活应用基础知识的能力.

| A. | Cl2 | B. | NH4Cl | C. | H2O | D. | KOH |
| X | ||
| Y | ||
| Z |
| A. | X是活泼非金属元素,其最高价氧化物的水化物是一种强酸 | |
| B. | Y是活泼非金属元素,其最高价氧化物的水化物是一种强酸 | |
| C. | Z是较活泼的非金属元素,其最高价氧化物的水化物是一种强酸 | |
| D. | Y单质的氧化性比Z单质的氧化性弱 |
| A. | 过氧化钠 | B. | 二氧化硫 | C. | 盐酸 | D. | 氯气 |
| A. | -OH与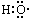 都表示羟基 都表示羟基 | B. | 聚丙烯的结构简式: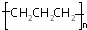 | ||
| C. | CH4分子的比例模型: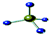 | D. | 次氯酸分子的电子式: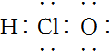 |
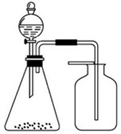
| A. | 浓氨水与固体CaO | B. | 稀盐酸与石灰石 | C. | 稀硝酸与铜片 | D. | 浓盐酸与MnO2 |
| A. |  2-乙基丁烷 2-乙基丁烷 | B. | CH2=CHCH2CH3 丁烯 | ||
| C. | 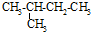 异戊烷 异戊烷 | D. |  4-甲基-2-戊烯 4-甲基-2-戊烯 |
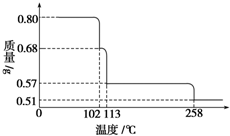 0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.