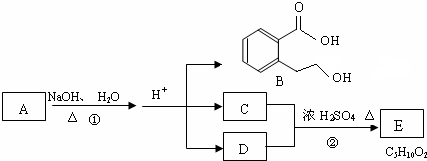
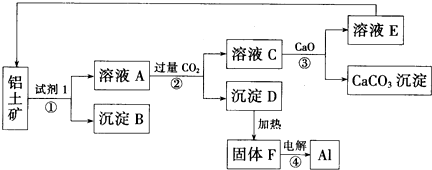
题目内容
5.(1)在100℃时,将0.400mol的二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②n3=n4(填“>”、“<”或“=”)
(2)氧族元素单质与H2反应情况:
| 元素 | O | S | Se | Te |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
1Al2Te3+6H2O═2Al(OH)3↓+3H2Te↑
(3)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型电源,其构造如图所示:a、b两个电极均由多孔的碳块组成,通人的氢气和氧气由孔隙中逸出,并在电极表面发生电极反应而放电.

其电极分别为a是负极,(填正或负),若介质为KOH溶液,其电极反应分别是:
a极:H2-2e-+2OH-=2H2Ob极:O2+4e-+2H2O=4OH-.
分析 (1)①先计算四氧化二氮的反应速率,再根据同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比计算二氧化氮反应速率;
②可逆反应达到平衡状态时,各物质的物质的量不变;
(2)根据元素守恒知,反应物中另一种物质是H2O,该反应中各元素化合价不变,根据原子守恒配平方程式即可;
(3)燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,所以a是负极、b是正极,电解质溶液呈碱性,所以负极上氢离子失电子和氢氧根离子反应生成水,正极上氧气得电子和水反应生成氢氧根离子.
解答 解:(1)①该反应中0-20s内v(N2O4)=$\frac{\frac{0.05mol-0}{2L}}{20s}$=0.00125mol/(L.s)=0.075mol/(L.min),同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比得v(NO2)=2v(N2O4)=2×0.075mol/(L.min)=0.15mol/(L.min),
故答案为:0.15;
②根据表中数据知,60s、80s时四氧化二氮的物质的量相等,说明60s时该反应达到平衡状态,所以n3=n4,故答案为:=;
(2)根据元素守恒知,反应物中另一种物质是H2O,该反应中各元素化合价不变,根据原子守恒配平方程式为1Al2Te3+6H2O═2Al(OH)3↓+3H2Te↑,故答案为:1;6H2O;2;3;
(3)燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,所以a是负极、b是正极,电解质溶液呈碱性,所以负极上氢离子失电子和氢氧根离子反应生成水,电极反应式为H2-2e -+2OH-=2H2O,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+4 e -+2H2O=4OH-,
故答案为:负;H2-2e -+2OH-=2H2O;O2+4 e -+2H2O=4OH-.
点评 本题考查化学反应平衡计算、方程式的配平及原电池原理,侧重考查基本原理,把握化学平衡中各物质的反应速率与计量数的关系、燃料电池特点即可解答,难点是电极反应式的书写,注意(3)题电解质溶液呈碱性,所以不能生成氢离子.

 阅读快车系列答案
阅读快车系列答案| A. | 向10ml 0.1mol•L-1NH4HSO4溶液中滴加10ml 0.1mol•L-1NaOH溶液:2c(SO42-)═c(NH4+)+c(NH3•H2O) | |
| B. | 等体积等浓度NaHCO3溶液和Na2CO3溶液混合:$\frac{C(HC{O}_{3}^{-})}{C({H}_{2}C{O}_{3})}$<$\frac{C(C{O}_{3}^{2-})}{C(HC{O}_{3}^{-})}$ | |
| C. | 物质的量浓度均为0.1mol•L-1Na2S溶液、NaHS溶液等体积混合所得溶液中:2c(OH--)-2c(H+)═3 c(H2S)+c(HS--)-c(S2--) | |
| D. | 将足量的AgCl分别放入:①5 ml水 ②10 ml 0.2mol•L-1MgCl2溶液③20ml0.3mol•L-1盐酸中溶解至饱和,c(Ag+):①>②>③ |
| A. | C3H8,C4H6 | B. | C3H6,C3H8O | C. | C2H6,C4H6O2 | D. | CH4O,C3H4O5 |
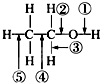 乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )
乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )| A. | 和金属钠反应时①键断裂 | |
| B. | 和乙酸发生酯化反应时②键断裂 | |
| C. | 在铜催化及加热条件下与O2反应时断裂①键和⑤键 | |
| D. | 在空气中完全燃烧时断裂①②③④⑤键 |
| A. | 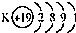 钾原子结构示意图 钾原子结构示意图 | |
| B. |  水合钠离子示意图 | |
| C. | 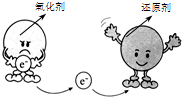 氧化还原反应与电子转移关系示意图 氧化还原反应与电子转移关系示意图 | |
| D. |  CH4分子示意图 |
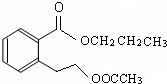 或
或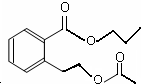 .
.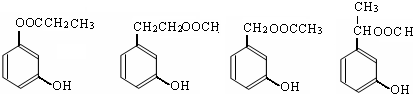 (任意两个).
(任意两个).