题目内容
【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2═2SOCl2,部分装置如图所示,回答以下问题:

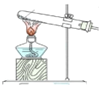
(1)仪器c的名称是________
(2)实验室制Cl2的化学方程式为________________________
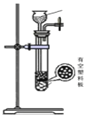
(3)下列四种制备 SO2的方案中最佳选择是_______
方案 | 甲 | 乙 | 丙 | 丁 |
发生装置 |
|
|
|
|
所选试剂 |
|
|
|
|
(4)d的虚线框内隐含两个装置,按气流方向顺序这两个装置的作用分别是_______________。
(5)实验结束后,将三颈烧瓶中混合物分离开的方法是 _________(已知SCl2的沸点为50℃)
(6)试设计一个简单实验方案验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论)____________________________________________。仪器自选。
限选的试剂:SO2、NaHCO3、酸性KMnO4、NaHSO3、蒸馏水、饱和石灰水、品红溶液、pH试纸。
(7)为测定某工厂的空气中二氧化硫含量,探究小组进行如下实验:在试管中加入一定量的含碘(I2)0.635mg的碘溶液,再加入2~3滴淀粉溶液,向试管中通入空气,当溶液由蓝色变为无色时恰好完全反应,共用去空气体积为500L。请通过计算判断出此空气中二氧化硫的浓度_____mg/m3。(化学方程式为:SO2+I2+2H2O=H2SO4+2HI)
【答案】 球形冷凝管 MnO2+4HCl (浓)==MnCl2+Cl2↑+2H2O 丁 除去HCl 干燥 蒸馏 配制相同物质的量浓度的NaHCO3和NaHSO3溶液,用酸度计(或pH试纸)测两种溶液的pH。前者的pH小于后者,证明H2SO3的酸性比H2CO3强。 0.320
【解析】(1). 仪器c是球形冷凝管,故答案为:球形冷凝管;
(2). 实验室通常利用浓盐酸和二氧化锰在加热的条件下制取氯气,化学方程式为:MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O;
(3). 根据题意可知,需要制得干燥纯净的SO2,甲装置采用加热NaHSO3固体的方法制得的SO2气体中含有较多的水蒸气,故甲不选;乙装置中18.4mol/L的硫酸浓度太大,水的含量太少,硫酸仍以分子形式存在,无法与铜反应制取SO2,故乙不选;因硝酸具有强氧化性,可以将Na2SO3氧化成Na2SO4,所以丙装置中不能生成SO2气体,故丙不选;丁装置中采用浓度较大的硫酸和K2SO3反应,既可以生成SO2,又可以减少SO2气体中混入水蒸气的量,故丁选;答案为:丁;
(4). 因制得的氯气中混有HCl和水蒸气杂质,所以先将气体通过饱和食盐水除去HCl,再通过浓硫酸除去水蒸气,故答案为:除去HCl;干燥;
(5). 因氯化亚砜(SOCl2)的沸点为77℃,SCl2的沸点为50℃,所以可采用蒸馏的方法将三颈烧瓶中混合物分离,故答案为:蒸馏;
(6). 根据题中提供的限选试剂,可以采用测定相同物质的量浓度的NaHCO3和NaHSO3溶液pH大小的方法比较H2SO3与H2CO3的酸性强弱,具体步骤为:配制相同物质的量浓度的NaHCO3和NaHSO3溶液,用酸度计(或pH试纸)测两种溶液的pH,前者的pH小于后者,证明H2SO3的酸性比H2CO3强,故答案为:配制相同物质的量浓度的NaHCO3和NaHSO3溶液,用酸度计(或pH试纸)测两种溶液的pH,前者的pH小于后者,证明H2SO3的酸性比H2CO3强。;
(7). 设500L空气中SO2的质量为x mg,
SO2 + I2+ 2H2O=H2SO4+2HI
64 254
x mg 0.635mg,![]() =
=![]() ,解得x=0.16mg,则空气中二氧化硫的浓度为0.16mg÷0.5m3=0.320mg/ m3,故答案为:0.320。
,解得x=0.16mg,则空气中二氧化硫的浓度为0.16mg÷0.5m3=0.320mg/ m3,故答案为:0.320。