题目内容
【题目】将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4H2O。
(1)Cu2+价电子排布式为_______;[Cu(NH3)4]SO4H2O中,1mol[Cu(NH3)4]2+含有σ键的数目为_____。
(2)SO42-中S原子轨道杂化类型为_____,H2O与H+以配位键形成H3O+,则H3O+的空间构型为____(用文字描述)。
(3)N、O、S第一电离能由大到小的顺序为___________。
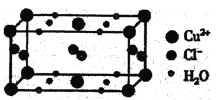
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是________。
【答案】 3d9 16mol sp3 三角锥形 N>O>S CuCl22H2O
【解析】试题分析:本题考查价电子排布式的书写,第一电离能的比较,σ键的确定,原子杂化方式的判断,离子空间构型的判断,晶体化学式的确定。
(1)Cu原子核外有29个电子,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,Cu2+的核外电子排布式为1s22s22p63s23p63d9,Cu2+的价电子排布式为3d9。每个NH3分子中含有3个氮氢σ键,Cu2+与4个NH3间形成4个配位键,配位键也是σ键,1个[Cu(NH3)4]2+含有的σ键为4+4![]() 3=16个,1mol[Cu(NH3)4]2+含有的σ键为16mol。
3=16个,1mol[Cu(NH3)4]2+含有的σ键为16mol。
(2)SO42-中S原子上的孤电子对数为![]() (6+2-4
(6+2-4![]() 2)=0,成键电子对数为4,S的价层电子对数为0+4=4,S原子为sp3杂化。H3O+与NH3互为等电子体,NH3分子的空间构型为三角锥形,H3O+的空间构型为三角锥形。
2)=0,成键电子对数为4,S的价层电子对数为0+4=4,S原子为sp3杂化。H3O+与NH3互为等电子体,NH3分子的空间构型为三角锥形,H3O+的空间构型为三角锥形。
(3)O、N都处于第二周期,O原子的价电子排布式为2s22p4,N原子的价电子排布式为2s22p3,N原子的2p轨道处于半充满较稳定,第一电离能:N![]() O;O、S都处于VIA族,同主族从上到下第一电离能逐渐减小,第一电离能:O
O;O、S都处于VIA族,同主族从上到下第一电离能逐渐减小,第一电离能:O![]() S;N、O、S第一电离能由大到小的顺序为N
S;N、O、S第一电离能由大到小的顺序为N![]() O
O![]() S。
S。
(4)用“均摊法”,Cu2+:8![]() +2
+2![]() =2,Cl-:4
=2,Cl-:4![]() +2=4,H2O:8
+2=4,H2O:8![]() +4
+4![]() =4,Cu2+、Cl-、H2O的个数比为2:4:4=1:2:2,该化合物的化学式为CuCl2·2H2O。
=4,Cu2+、Cl-、H2O的个数比为2:4:4=1:2:2,该化合物的化学式为CuCl2·2H2O。

 阅读快车系列答案
阅读快车系列答案【题目】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2═2SOCl2,部分装置如图所示,回答以下问题:

(1)仪器c的名称是________
(2)实验室制Cl2的化学方程式为________________________
(3)下列四种制备 SO2的方案中最佳选择是_______
方案 | 甲 | 乙 | 丙 | 丁 |
发生装置 |
|
|
|
|
所选试剂 |
|
|
|
|
(4)d的虚线框内隐含两个装置,按气流方向顺序这两个装置的作用分别是_______________。
(5)实验结束后,将三颈烧瓶中混合物分离开的方法是 _________(已知SCl2的沸点为50℃)
(6)试设计一个简单实验方案验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论)____________________________________________。仪器自选。
限选的试剂:SO2、NaHCO3、酸性KMnO4、NaHSO3、蒸馏水、饱和石灰水、品红溶液、pH试纸。
(7)为测定某工厂的空气中二氧化硫含量,探究小组进行如下实验:在试管中加入一定量的含碘(I2)0.635mg的碘溶液,再加入2~3滴淀粉溶液,向试管中通入空气,当溶液由蓝色变为无色时恰好完全反应,共用去空气体积为500L。请通过计算判断出此空气中二氧化硫的浓度_____mg/m3。(化学方程式为:SO2+I2+2H2O=H2SO4+2HI)
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向硅酸钠溶液中滴加盐酸 | 有白色胶状沉淀生成 | 非金属性:Cl>Si |
B | 向溶液X中加入稀盐酸,并将产生的无色无味气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有CO32-或HCO3- |
C | 向1mL0.1mol/L MgSO4溶液中,滴入2滴0.1mol/L1NaOH溶液,再滴入2滴0.1mol/LCuSO4溶液 | 起初生成的白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2] <Ksp[Mg(OH)2] |
D | 向鸡蛋白溶液中滴入HgCl2溶液 | 有白色沉淀 | 蛋白质发生盐析 |
A. A B. B C. C D. D